
除去SO2中少量的SO3,可将混合气体通入( )
A.装水的洗气瓶 B.装饱和NaHSO3溶液的洗气瓶
C.装98%浓H2SO4的洗气瓶 D.装NaOH溶液的洗气瓶
科目:高中化学 来源: 题型:阅读理解
| 资料:①H2S可溶于水(约1:2),其水溶液为二元弱酸. ②H2S可与许多金属离子反应生成沉淀. ③H2S在空气中燃烧,火焰呈淡蓝色. |

| 实验操作 | 实验现象 | |
| 实验1 | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
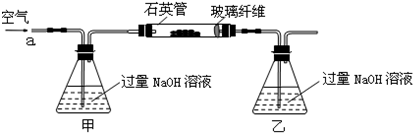
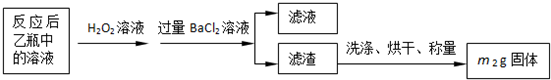
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
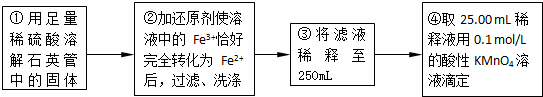
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| S | 112.8 | 444.6 | 略 |
| S2C12 | -77 | 137 | △ S2C12遇水生成HCl、SO2、S,300℃以上完全分解; S2C12+C12 2SCl2 |
| SCl2 | -121 | 59.6(分解) |
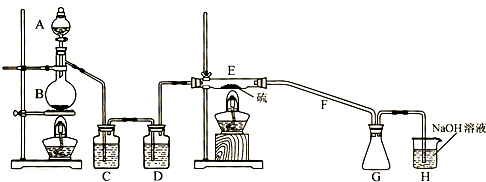
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
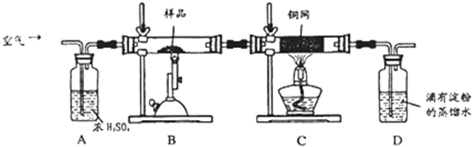
查看答案和解析>>
科目:高中化学 来源: 题型:
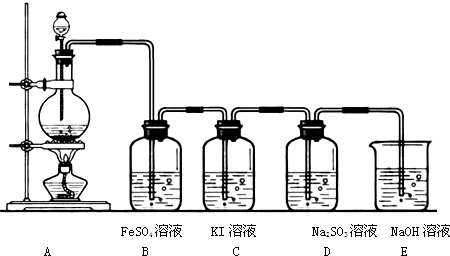
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com