
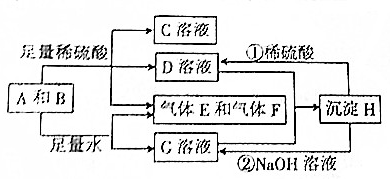
分析 根据转化关系D和G两溶液混合得沉淀H,H即能与酸反应又能与碱反应,则H应为Al(OH)3,则G为NaAlO2,D为Al2(SO4)3,化合物B为淡黄色粉末,则B为Na2O2,A为一种金属单质,则A为Al,过氧化钠、铝与酸或水反应得两种气体为氢气、氧气,所以E和F为H2和O2,得溶液C为Na2SO4,据此解答
解答 解:(1)根据上面的分析可知,化合物B的化学式为Na2O2,
故答案为:Na2O2;
(2)反应①的离子方程式为Al(OH)3+3H+=Al3++3H2O,②的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)根据反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,10.8gAl即0.4mol,与足量的NaOH溶液反应,得到的还原产物氢气的物质的量为0.6mol,其质量为0.6×2g=1.2g,
故答案为:1.2.
点评 本题考查无机物推断,涉及钠元素单质化合物性质,以A的颜色及发生的反应为突破口采用正逆结合的方法进行推断,明确物质的性质是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 含20个电子的氯原子的符号为:3517Cl | |
| B. | 四氯化碳的球棍模型: | |
| C. | 氩的原子结构示意图: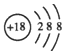 | |
| D. | 乙烯的结构简式:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和Cl2光照 | B. | 氯乙烯发生加聚反应 | ||
| C. | 正丙醇、异丙醇、浓硫酸共热至170℃ | D. | 甲醇、乙醇、浓硫酸共热至140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol CO2、CO的混合气中含有的碳原子数为NA | |
| B. | 常温常压下,11.2L氯化氢气体中含有的分子数为0.5NA | |
| C. | 1mol氯气与足量的氢氧化钠溶液完全反应转移的电子数为2NA | |
| D. | 1L 1mol•L-1 CuCl2溶液中含有的氯离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )
如图所示装置中,a、b都是惰性电极,通电一段时间后,b电极附近溶液呈红色.下列说法中正确的是( )| A. | X是负极,Y是正极 | B. | Cu电极逐渐溶解 | ||
| C. | CuSO4溶液的pH逐渐减小 | D. | CuSO4溶液的pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯碱工业中,氢氧化钠在电解槽的阳极区产生 | |
| B. | 硫酸工业中,二氧化硫催化氧化使用催化剂,可增加二氧化硫的转化率 | |
| C. | 合成氨工业中,利用氨易液化,分离出N2、H2循环使用,可提高氨的产率 | |
| D. | 接触法制硫酸中三氧化硫用水吸收制成浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.4mol/L的甲酸中含甲酸的分子数为0.04NA | |
| B. | 在标准状态下,22.4L乙烷与乙烯的混合气体,含碳原子数为2NA | |
| C. | 18g水中含有的电子数为10NA | |
| D. | NA个23Na原子的质量为23g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com