
【题目】下列浓度关系正确的是
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
【答案】D
【解析】
A.氯水中只有一般分氯气溶解,故c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]等式左边若换成溶解的氯气才正确,故A错误;
B.根据Cl2+H2O![]() HClO+H++Cl-,HCl完全电离,而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),故B错误;
HClO+H++Cl-,HCl完全电离,而HClO部分电离,可知正确的顺序c(H+)>c(Cl-)>c(ClO-)>c(OH-),故B错误;
C.等物质的量的强碱与弱酸混合生成强碱弱酸盐溶液显碱性c(OH-)>c(H+),再根据溶液中电荷守恒可以判断c(Na+)>c(CH3COO-),故C错误;
D.Na2CO3溶液中,钠离子浓度最大,因为碳酸根离子有一小部分水解生成碳酸氢根离子和氢氧根离子,显碱性,溶液中氢离子来源于水的电离,且电离程度较小,故离子浓度为c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),故D正确;
故答案为D。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是()
A.0.01mol·L﹣1NH4Al(SO4)2溶液与0.02mol·L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3·H2O
B.一定条件下,将0.5molN2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ·mol﹣1
2NH3(g)△H=﹣38.6kJ·mol﹣1
C.2H2(g)+O2(g)=2H2O(g)△H=﹣571.6kJ·mol﹣1,则H2的燃烧热为571.6kJ·mol﹣1
D.CO(g)的燃烧热是283.0kJ·mol﹣1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0kJ·mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中,正确的是( )
A. 稀硫酸滴在铜片上:Cu+2H+===Cu2++H2↑
B. 稀硫酸与Ba(OH)2溶液混合:SO![]() +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C. 稀硝酸滴在大理石上:CaCO3+2H+===Ca2++H2CO3
D. 氧化铁与稀盐酸混合:Fe2O3+6H+===2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的离子是( )
A.①③⑤⑦⑧B.②④⑥⑧C.①⑥D.②④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z。下列说法中正确的是( )
A. Z是共价化合物
B. Z可表示为M2Y
C. Z的电子式可表示为 ![]()
D. M形成+2价阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL0.2mol/L的FeCl3溶液置于烧杯中,向其中加入一定量的Fe、Cu混合物,充分反应后仍有固体剩余,下列叙述一定正确的是( )(设溶液体积不变,不考虑水解因素)。
A.烧杯中有Fe无Cu,c(Fe2+)=0.2mol/L
B.烧杯中有Cu无Fe,c(Fe2+)=0.3mol/L
C.烧杯中有Cu无Fe,0.2mol/L![]() c(Fe2+)
c(Fe2+)![]() 0.3mol/L
0.3mol/L
D.烧杯中Fe、Cu均有,c(Fe2+)=0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂。实验室利用
是一种补铁强化剂。实验室利用![]() 与甘氨酸
与甘氨酸![]() 制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4g![]() 和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是________。
(2)装置B中盛有的试剂是:_______;装置D的作用是________。
(3)向![]() 溶液中加入
溶液中加入![]() 溶液可制得
溶液可制得![]() ,该反应的离子方程式为________。
,该反应的离子方程式为________。
(4)过程I加入柠檬酸促进![]() 溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
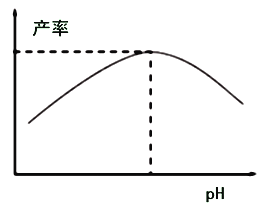
①pH过低或过高均导致产率下降,pH过高导致产率下降其原因是________;
②柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
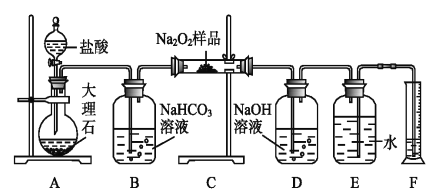
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)合成氨工业生产中所用的α-Fe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4﹕5,其中FeO、Fe2O3的物质的量之比为__________。
②当催化剂中+2价铁与+3价铁的物质的量之比为1﹕2时,其催化活性最高,此时铁的氧化物的混合物中铁的质量分数为 _______________。 (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①用FeO、Fe2O3和稀盐酸、氯气制取FeCl3溶液的离子方程式为________________________、______________________________、______________________________。检验溶液中Fe3+存在的试剂是_______________。
②写出FeCl3溶液与金属铜发生反应的化学方程式_____________________________,当转移电子数为6.02×1024时,被氧化的物质的质量为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com