
根据原子结构及元素周期律的知识,下列叙述正确的是( )
A. 由于相对分子质量:HCl>HF,故沸点:HCl>HF
B. 由于氮元素的最低化合价只有﹣3价,故NH5这种物质不可能存在
C. 硅处于金属与非金属的过渡位置,硅可用作半导体材料
D. Cl﹣、S2﹣、Ca2+、K+半径逐渐减小
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:2015-2016学年福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列变化中,吸收的能量用于克服分子间作用力的是
A.加热氢氧化钠晶体使之熔化
B.电解水使之分解
C.碘单质受热升华
D.加热二氧化硅晶体使之熔化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
通常用来衡量一个国家石油化工发展水平标志的是
A.甲烷的产量 B.苯的产量 C.乙醇的产量 D.乙烯的产量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆四十二中高一下期中化学试卷(解析版) 题型:选择题
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下不正确的是( )
元素性质 | 元素编号 | ||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
最低负化合价 | ﹣2 | ﹣3 | 无 | ﹣3 | ﹣1 | 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆四十二中高一下期中化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A. 两种不同元素的原子中,137Cs比131I多6个中子
B. 多电子原子中,在离核较远的区域内运动的电子能量较低
C. 同主族元素的简单阴离子还原性越强,其氢化物的稳定性越强
D. 短周期元素X和Y的原子序数相差2,则X与Y可能同周期,也可能同主族
查看答案和解析>>
科目:高中化学 来源:2015-2016学年重庆四十二中高一下期中化学试卷(解析版) 题型:选择题
元素性质呈周期性变化的决定因素是( )
A. 元素原子半径大小呈周期性变化
B. 元素相对原子质量依次递增
C. 元素原子最外层电子排布呈周期性变化
D. 元素的最高正化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高一下学期期末考试化学试卷(解析版) 题型:填空题
(1)第三周期元素中,化学性质最不活泼的是 ,可用于制半导体材料的元素是_______.
(2)Cl元素在元素周期表中的位置是 周期 族。
(3)第三周期元素中元素中,最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(4)在C、N、O、F中,原子半径最大的是 .
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期末考试化学试卷(解析版) 题型:填空题
Ⅰ.某温度下,在2 L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图。反应在t1 min时到达平衡,如图所示:
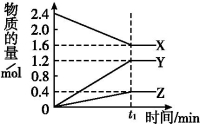
(1)该反应的化学方程式是 。
(2)①若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为 ;在此t1 min时间内,用H2表示反应的平均速率v(H2)为 。
Ⅱ. 亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
5Na2SO3+2KIO3+H2SO4 ===5Na2SO4+K2SO4+I2+H2O,
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-→IO2-+SO42-(慢)
②IO2-+2SO32-→I-+2SO42-(快)
③5I-+6H++IO3-→3I2+3H2O(快)
④I2+SO32-+H2O→2I-+SO42-+2 H+(快)
(1)根据上述条件推测,此反应的总的反应速率由 步反应决定。(填“①、②、③、④”)。
(2)若预先加入淀粉溶液,由题述看,必须在 离子消耗完时,才会使淀粉变蓝的现象产生。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省扬州市高二选修下学期期末调研化学试卷(解析版) 题型:填空题
废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如下:

(1)①写出铜帽溶解过程中发生反应的化学方程式 。
②铜帽溶解后需将溶液中过量H2O2除去。除去H2O2的简便方法是 。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)含量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节pH=3~4,加入过量KI,用Na2S2O3标准溶液滴定至终点。上述过程中的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 I2+2 =2I-+
=2I-+
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②若滴定前溶液中H2O2没有除尽,所测得的Cu2+的含量将会 (填“偏高”、“偏低”、“不变”)。
(3)已知pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
完全沉淀的pH | 3.2 | 8.8 | 8.9 |
实验中可选用的试剂:30% H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1 NaOH。
由回收铜后的滤液制备ZnO的实验步骤依次为:
① ;
② ;
③ 过滤;
④ ;
⑤ 过滤、洗涤、干燥
⑥ 900℃煅烧。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com