
氮是地球上含量丰富的—种元素,氮及其化合物在工农业生产、生活中有着重要作用,
减少N 的氧化物在大气中的排放是环境保护的重要内容之一。
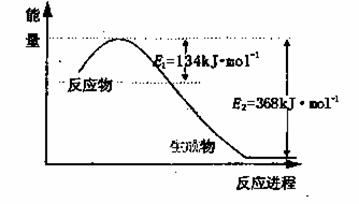
(1)上图是1molNO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式________________________________________;
又知:N2(g)+ O2(g)=2NO(g) △H=+180kJ/mol;2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol,则反应2NO(g)+2CO(g) N2(g)+ 2CO2(g)的△H=_______________;
N2(g)+ 2CO2(g)的△H=_______________;
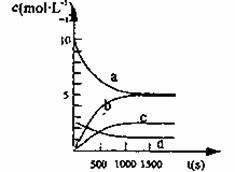
(2)一定温度下,在2L密闭容器中NO2和O2可发生下列反应:4NO2(g) + O2(g) 2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
2N2O5(g)。已知体系中n(NO2)随时间变化加下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
①写出该反应的平衡常数表达式:K=__________,己知:K300℃>K350℃,则该反应是______热反应。
②反应达到平衡后,NO2的转化率为________________,此时若再通入一定量氮气,则NO2的转化率将___________(填“增大”、“减小”、“不变”);
③右图中表示N2O5的浓度的变化曲线是____,用O2表示从0~500 s内该反应的平均速率v=________。
科目:高中化学 来源: 题型:
右图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
A.离子半径:
 B.Z元素形成的氧化物都是共价化合物
B.Z元素形成的氧化物都是共价化合物
C.气态氢化物稳定性:
D.三种元素中,M的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y为短周期元素,X位于第IA族,X与Y可形成化合物X2Y,下列说法不正确的是
A.两元素还可能形成原子个数比为1:1的化合物
B.X与Y的简单离子可能具有相同电子层结构
C. X的原子半径一定大于Y的原子半径
D.X2Y可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作完全正确的是
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的氯化钾溶液1000ml | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端口放出,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3=9Fe(NO3)x+NO↑+14H2O,下列判断合理的是
A.Fe(NO3)x中的x为2
B.磁性氧化铁中的铁元素全部被氧化
C.稀HNO3在反应中只作氧化剂
D.反应中每生成0.4 mol还原产物,就有1.2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是( )
| 化学事实 | 类推结论 | |
| A | pH=3的盐酸稀释1000倍后pH=6 | pH=6的盐酸稀释1000倍后pH=9 |
| B | 电解熔融MgCl2的可制取金属镁 | 用电解熔融NaCl的方法也可制取金属钠 |
| C | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为 ,
b与c形成的化合物的电子式为  。下列说法中正确的是:
。下列说法中正确的是:
A.原子半径:a>c>d>b
B.电负性:a>b>d>c
C.最高价含氧酸的酸性:c>d>a
D.原子序数:d>a>c>b
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素的单质及其化合物的研究和应用在工农业生产中有着非常重要的地位。工业制硝酸的主要反应之一是
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H=-akJ/mol(a>0)。
4NO(g)+6H2O(g) △H=-akJ/mol(a>0)。
 (1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量
(1)如果将4mol NH3和5mol O2放入容器中,达到平衡时放出热量
0.8akJ,则平衡时NH3的转化率为 。
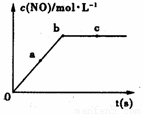
(2)在一定条件下,容积固定的密闭容器中进行上述反应,NO的浓度与时间关系如图所示,则NO的a、b、c三点的反应速率v(a正)、v(b逆)、v(c正)的大小关系是 。
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
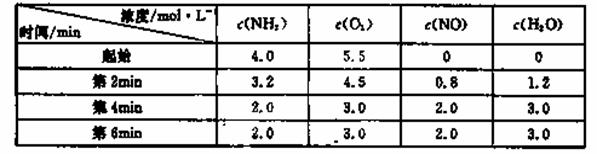
①第2min到第4mim,反应速率v(O2)= ;
②第2min时改变了条件,改变的条件可能是 (从所给选项中选择);
A.降低温度 B.增加了生成物 C.减小压强 D.使用了高效催化剂
③在与第4min相同的温度下,若起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为2moI/L,则该反应 (填“正反应方向进行”、“逆反应方向进行”、“不移动”)。
(4)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。尿素(H2NCONH2)是一种非常重要的高氮化肥,在温度70—95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2,尿素与NO、NO2三者等物质的量反应的化学方程式为 。
(5)目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
则1mol甲烷直接将NO2还原为N2的焓变为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com