
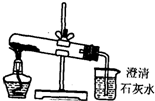
 设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,难以达到预期目的是( )
设计下列实验方案鉴别Na2CO3和NaHCO3两种白色粉末,难以达到预期目的是( )| A、分别向等量的白色粉末中加等体积、等浓度的稀盐酸,比较生成气体的快慢 |
| B、分别将等量的白色粉末配成溶液,然后加入BaCl2溶液,看是否有沉淀生成 |
| C、分别将等量的白色粉末配成溶液,然后加入澄清石灰水,看是否有沉淀生成 |
| D、分别将等量的白色粉末用图中装置进行实验,比较澄清石灰水是否变混浊 |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、Y2为0.2 mol/L |
| B、Y2 为0.35 mol/L |
| C、X2 为0.2 mol/L |
| D、Z为 0.4 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑤ | B、②④ | C、②④⑤ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 高温高压 |
| A、使用铁触媒,可使氮气和氢气混合气体之间的反应在较低温度下取得较高的反应速率 |
| B、工业上选择上述条件下合成氨,可以使氮气全部转化为氨 |
| C、上述化学平衡的移动受到温度、反应物的浓度、压强等因素的影响 |
| D、温度升高,不利于氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | KNO3(NaCl) | 水 | 重结晶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Ba2+、NO3-、CO32- |
| B、Ba2+、K+、Cl-、NO3- |
| C、Mg2+、NH4+、SO42-、Cl- |
| D、Fe2+、Na+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正.逆反应速率同时增大,平衡不移动 |
| B、正.逆反应速率同时增大,NH3百分含量增大 |
| C、正反应速率增大,逆反应速率减小,平衡向逆反应移动 |
| D、正.逆反应速率不变,平衡不移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com