
| A、在298 K时,11.2 L H2完全燃烧生成液态水放出的热量为142.9 kJ | ||
| B、H2(g)的燃烧热是285.8 kJ,则2H2O(l)═2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
| C、在298 K时,2H2(g)+O2(g)═2H2O(g)△H<-571.6 kJ?mol-1 | ||
D、H2(g)+
|
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,但无净水作用 |
| B、可利用工业生产产生的二氧化碳制造全降解塑料 |
| C、上海世博会很多场馆的外墙使用非晶硅薄膜,以充分利用太阳能,体现低碳经济 |
| D、CO2和CH4等物质的大量排放会造成温室效应的加剧 |
| E、CO2和CH4等物质的大量排放会造成温室效应的加剧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化亚铁与盐酸反应:FeO+2H+=Fe2++H2O |
| B、向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
| C、向CuCl2溶液中加入NaOH溶液:Cu2++OH-=Cu(OH)2↓ |
| D、氯化铁溶液中加入铜粉:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、T℃时,1LpH=6的纯水中,含有的OH-数目为1×10-6NA |
| B、12.0gNaHSO4固体中含有的阳离子数目为0.1NA |
| C、50g98%的浓硫酸中,所含的氧原子数目为2NA |
| D、1molNa2O2与足量CO2充分反应转移的电子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
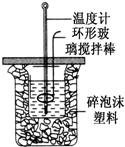 用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.
用50mL 0.50mol?L-1盐酸与50mL 0.55mol?L-1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热.| 验验 编号 | 起始温度(℃) | 终止温度 (℃) | 温度差 (℃) | ||
| 盐酸 | 氢氧化钠 | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.4 | 24.8 | 24.65 | 27.8 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
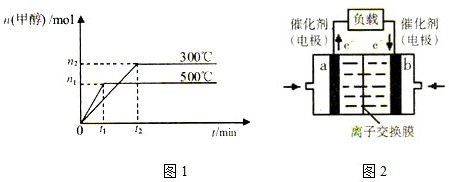
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com