
NA表示阿伏加德罗常数的值,下列说法正确的是
A.7.8 g Na2O2中含有的离子总数目为0.4NA
B.1mol 苯分子中含有碳碳双键数目为3NA
C.标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22. 4L
D.16g CH4与18 g NH4+ 所含电子数均为10NA
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:选择题
下列离子方程式的书写与结论均合理的是
选项 | 离子方程式 | 结论 |
A | AgCl(s) + I-( aq) | 溶解度:AgI > AgCl |
B | Fe2++ H2O2 +2H+= Fe3++2H2O | 氧化性:H2O2 > Fe3+ |
C | CO32- + CO2 + H2O = 2HCO3- | 稳定性:HCO3- > CO32- |
D | NH3 + H3O+=NH4++ H2O | 得质子能力:NH3 > H2O |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:填空题
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题。
(1)写出F元素的电子排布式:_______________________________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为_______________________________________。
(3)已知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是___。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是________________________________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
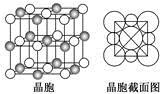
晶胞中距离一个B+最近的B+有________个。若晶体密度为ρ g·cm-3,阿伏加德罗常数的值用NA表示,则E-的离子半径为________cm(含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
仅用下表提供的仪器和药品,就能达到相应实验目的的是
编号 | 仪器 | 药品 | 实验目的 |
A | 托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒 | NaCl固体、蒸馏水 | 配制一定质量分数的NaCl溶液 |
B | 分液漏斗、烧瓶、锥形瓶、导管及橡皮塞 | 盐酸、大理石、碳酸钠溶液 | 证明非金属性:Cl>C>Si |
C | 酸式滴定管、胶头滴管、铁架台(带铁夹) | 已知浓度的盐酸、待测NaOH溶液 | 测定NaOH溶液的物质的量浓度 |
D | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 | 提纯混有MgCl2杂质的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:简答题
【化学与技术】
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:请回答下列问题。
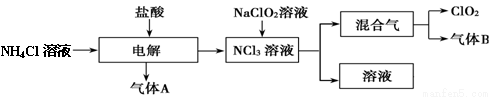
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用 。
A饱和食盐水 B碱石灰 C浓硫酸 D蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是 。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,化学反应方程式为 ,此法缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5)科学家最近又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:实验题
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。

(1)按上图组装仪器,并______________________________________________;
(2)将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3)从左端导气管口处不断地缓缓通入H2,____________________________,
点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,________________________________________;
(5)测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ.铁矿石中含铁量的测定,流程如下。
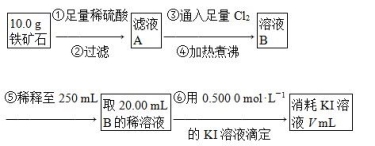
(1)步骤④中煮沸的作用是___________________________________________。
(2)步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、250 mL容量瓶、________。
(3)下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c.滴定过程中可利用淀粉溶液作指示剂
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30 s内溶液不恢复原来的颜色,再读数
f.滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
(4)若滴定过程中消耗0.500 0 mol·L-1 KI溶液20.00 mL,则铁矿石中铁的百分含量为________。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是
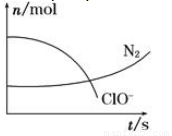
A.还原剂是含CN-的物质,氧化产物只有N2
B.氧化剂是ClO- , 还原产物是HCO3-
C.配平后氧化剂与还原剂的化学计量数之比为5∶2
D.若生成2.24 L N2(标准状况),则转移电子0.5 mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下表中关于离子方程式评价合理的是
选项 | 化学反应及其离子方程式 | 评价 |
A | 醋酸钠溶于水:CH3COO-+H2O=== CH3COOH+OH- | 正确 |
B | 在氢氧化钠溶液中滴加少量氯化铝: Al3++3OH-===Al(OH)3↓ | 错误,Al(OH)3能溶于氢氧化钠 |
C | 铁加入到过量的稀硝酸溶液中:3Fe + 8H+ +2 | 正确 |
D | 在硫酸铝钾溶液中滴加氢氧化钡溶液至沉淀的物质的量最多:3Ba2++6OH-+2Al3++3 | 错误,Al3+与OH-的化学计量数之比为1∶3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com