
(16分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。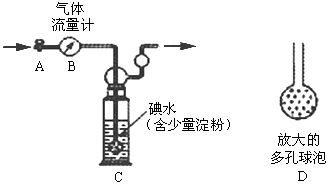
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:
。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种: 。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
(填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如以下流程图所示:
(4)写出步骤②中反应的化学方程式 。
(5)步骤③中洗涤沉淀的方法是 。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为 (用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案是否合理,说明理由:
。
科目:高中化学 来源: 题型:


 Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O
Fe(OH)3+3H+ 2H++CaCO3=Ca2++CO2↑+H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O Mn3O4+SO2↑+2SO3↑+3H2O
Mn3O4+SO2↑+2SO3↑+3H2O查看答案和解析>>
科目:高中化学 来源: 题型:
| n(SO32-) |
| n(HSO3-) |
|
91:9 | 1:1 | 9:91 | ||
| 室温下pH | 8.2 | 7.2 | 6.2 |
| n(SO32-) |
| n(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g) 2SO3(g) ΔH<0。
某温度下,将2mol SO2和1mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2012届浙江省衢州二中高三下学期第一次综合练习理科综合试卷(化学部分) 题型:填空题
钒(V)及其化合物在工业催化、新材料和新能源等领域中有广泛的应用,其中接触法制硫酸工业中就要用到V2O5作催化剂:
2SO2(g)+O2(g)  2SO3(g) ΔH<0。
2SO3(g) ΔH<0。
某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,在V2O5作催化剂下经5min反应达平衡,SO2的平衡转化率(α)为80%。
(1)5min内 v(SO3 )= mol·L-1·min-1
(2)该温度下平衡常数K=
(3)若缩小容器体积,至达到新的平衡,在图中画出反应速率变化图象。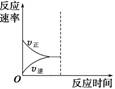
(4)硫酸工业尾气SO2用浓氨水吸收,反应的离子方程式是 ,吸收后的产物最终可制成肥料硫铵[即(NH4)2SO4]。
(5)某含钒化合物及硫酸的电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如下图所示。
①用该电池电解(NH4)2SO4溶液生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极电极反应式可表示为 ;若电解得1mol(NH4)2S2O8,则电池左槽中H+将 (填“增大”或“减少”) mol。
②电池使用一段时间后对其进行充电,充电过程中,阳电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇区高三上学期期末(一模)考试化学试卷(解析版) 题型:填空题
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中 随pH变化的关系:
随pH变化的关系:
|
|
91:9 |
1:1 |
9:91 |
|
室温下pH |
8.2 |
7.2 |
6.2 |
(1)简述 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
c (HSO3-) + 2c (SO32-) = _______ mol/L 。
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式: 。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com