
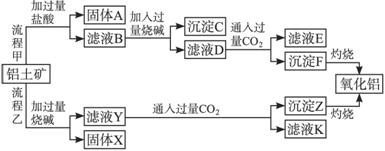
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成![]() 的离子方程式为_____________________________。
的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_______________(填化学式),写出该溶质的一种用途_______________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
(1)Al2O3+6H+====2Al3++3H2O
(2)SiO2+2OH-====![]() +H2O
+H2O
(3)硫氰化钾(或硫氰酸钾、苯酚溶液等合理答案)
(4)NaHCO3 制纯碱或做发酵粉等合理答案
(5)5.6×10-10 mol·L-1
解析:Al2O3、SiO2、Fe2O3、MgO中,Al2O3、SiO2与NaOH溶液反应,MgO、Fe2O3不与NaOH溶液反应;除SiO2不与盐酸反应外,Al2O3、Fe2O3、MgO均与盐酸反应;还有反应[Al(OH)4]-+CO2=====Al(OH)3↓+![]() ,结合以上知识点不难对(1)(2)(3)(4)作答。
,结合以上知识点不难对(1)(2)(3)(4)作答。
(5)pH=13.00时,c(OH-)=0.1 mol·L-1,Ksp=c(Mg2+)·c2(OH-)=5.6×10-12,可得c(Mg2+)=5.6×10-10 mol·L-1。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
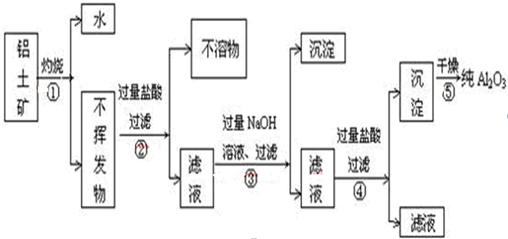
| A、④⑤ | B、③④ | C、②⑤ | D、①② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com