
几种短周期元素的原子半径及主要化合价如下表:

下列叙述正确的是( )
A. X、Y元素的金属性X<Y
B. 一定条件下,Z单质与N的常见单质直接生成ZN2
C. Y的最高价氧化物对应的水化物能溶于稀氨水
D. 一定条件下,M单质可以与N单质直接化合,M、N的非金属性N>M
科目:高中化学 来源:2015-2016学年浙江省宁波市高一下学期学考期中化学试卷(解析版) 题型:选择题
下列各项比较中,正确的是
A. 原子半径:N<O<F
B. 热稳定性:HCl<HBr<HI
C. 元素的金属性:Na<Mg<Al
D. 酸性:H2SiO3<H3PO4<H2SO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
A. 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法
B. 纸层析法通常把不与水混溶的有机溶剂作为流动相
C. 洗涤沉淀时应开大水龙头,增加洗涤剂过滤速度,带走杂质
D. 减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相背,以防止滤液被吸出抽滤瓶外
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
下列各组反应属于铝热反应的是
A.Al2O3+NaOH B.Al+Fe3O4 C.Al+CuSO4 D.Al+HCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:填空题
(I有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放人3mol·L—1H2SO4溶液中,乙同学将电极放入3mol·L-1的NaOH溶液中,如图所示。
(1)写出甲池中总反应的离子方程式: 正极为: (填“铝片”或“镁片”),该电池工作一段时间后,溶液的pH值 (填“变大”“变小”或“不变”)。
(2)写出乙池中总反应的离子方程式: ;工作时氢氧根离子往 (填“正极”或“负极”)迁移。
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出 活动性更强(填写元素符号)。
(4)通过上述实验分析,“直接利用金属活动性顺序判断原电池的正负极”这种做法可靠吗? (填“是”或“否”)若填是,下问不用回答;若填否,请写出一种判断原电池正负极的可行的实验方法。
(5)某鱼雷采用Al-Ag2O动力电池,以溶解有氢氧化钾的流动海水为电解液,电池反应为:2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O,则该电池的负极为
正极离子反应式为:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
如下图所示:△H1=-393.5kJ•mol-1,△H2=-395.4kJ•mol-1,下列说法或表示正确的是( )

A.C(s、石墨)= C(s、金刚石)△H=+1.9kJ•mol-1
B.石墨和金刚石的相互转化是物理变化
C.金刚石的稳定性强于石墨的稳定性
D.石墨和金刚石是同位素
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列变化属于放热反应的是( )
①碳与二氧化碳化合
②生石灰与水反应生成熟石灰
③Zn与稀硫酸反应
④浓硫酸溶于水
⑤Ba(OH)2.8H2O与NH4Cl反应
⑥甲烷与氧气的燃烧
A.①②④⑥ B.①④⑤ C.②③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:填空题
NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。

若A为NO2,B为O2,则负极的电极反应式为______________________________;
(2)有一种用CO2生产甲醇燃料的方法:
CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)=H2O(l) △H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)  COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
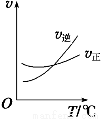

①0~6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________________
移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)_________ mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是__________;(填“增大”、“减小”或“不变”)
⑤比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_______T(15)(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.10mol·L-1的浓氨水:Al3+、NH4+、NO3-、I-
C.与Al反应放出H2的溶液:Mg2+、Ca2+、NO3-、HCO3-
D.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com