
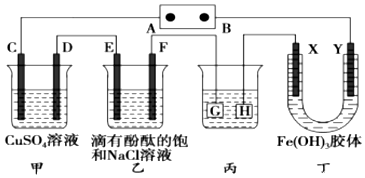
分析 (1)将直流电源接通后,F极附近呈红色,可知道氢离子在该电极放电,所以F极是阴极,B为电源负极、A为电源正极,据此判断其它各个电极的名称,和电极反应,而Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷;
(2)C、D、E、F电极转移的电子数目相等,结合电极反应式根据转移电子数可计算生成的单质的量;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,电镀液含有镀层金属阳离子;
根据乙中氢氧根离子的浓度计算其物质的量,结构电极反应式计算转移电子物质的量,各个电极上转移的电子数是相等的,据此计算丙中析出Ag的物质的量,进而计算质量;
电解硫酸铜的过程中水放电生成氧气,有硫酸生成,氢离子浓度增大,所以酸性增强,甲中溶液的pH变小
(4)铁电极做阳极则该电极放电的是金属铁本身.
解答 解:将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F极是阴极,B为电源负极、A为电源正极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极;
(1)B电极是电源的负极,C、D、E、F电极发生的电极反应分别为:2H2O-4e-=O2+4H+、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,Y极是阴极,该电极颜色逐渐变深,说明氢氧化铁胶体向该电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,
故答案为:负极;2H2O-4e-=O2+4H+;氢氧化铁胶体粒子带正电荷;
(2)C、D、E、F电极发生的电极反应分别为:2H2O-4e-=O2+4H+、Cu2++2e-═Cu、2Cl-═Cl2↑+2e-、2H++2e-═H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2;
故答案为:1:2:2:2;
(3)电镀装置中,镀层金属必须做阳极,镀件做阴极,所以H应该是镀件,电镀液含有镀层金属阳离子,故电镀液为AgNO3溶液;
当乙中溶液的c(OH-)=0.1mol•L-1时(此时乙溶液体积为500mL),根据电极反应2H2O+2e-═H2↑+2OH-,则放电的氢离子的物质的量为:0.1mol/l×0.5L=0.05mol,当转移0.05mol电子时,丙中镀件上析出银的质量=108g/mol×0.05mol=5.4g,
电解硫酸铜的过程中水放电生成氧气,有硫酸生成,所以氢离子浓度增大,所以酸性增强,甲中溶液的pH变小,
故答案为:镀件;AgNO3;5.4g;变小;
(4)C电极换为铁,则阳极铁失电子,阴极铜离子得电子,电解池反应为:Fe+Cu2+$\frac{\underline{\;通电\;}}{\;}$Cu+Fe2+,
故答案为:Fe+Cu2+$\frac{\underline{\;通电\;}}{\;}$Cu+Fe2+.
点评 本题考查学生有关电解池的工作原理知识,综合性很强,难度较大,要求学生熟记教材知识,学以致用.


科目:高中化学 来源: 题型:选择题
| A. | 冰融化,克服的是H2O的分子间作用力 | |
| B. | 同分异构现象存在,是有机化合物种类繁多的原因之一 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | Na2 O2属于离子化合物,该物质中存在离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
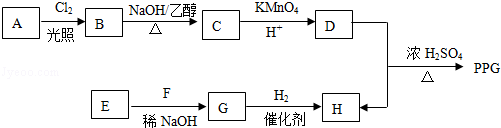
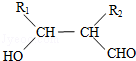
 .
.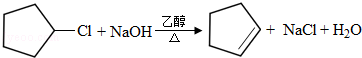 .
.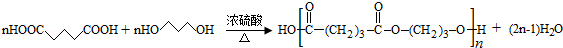 .
.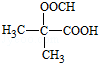 (写构简式)
(写构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短期保存Br2:盛于磨口的细口瓶中,并用水封,瓶盖严密 | |
| B. | 锂、钠、钾都保存在煤油中,密封 | |
| C. | 氨水、浓盐酸易挥发必须保存在棕色磨口细口瓶中 | |
| D. | 红磷无需密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
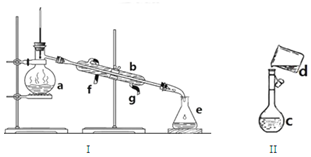 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、[Al(OH)4]-、CO32- | |
| B. | 在含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| C. | 在c(H+)=10-13mol•L-1的溶液中:NH4+、Al3+、SO42-、NO3- | |
| D. | 在pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液 | |
| B. | c(H+)=10-6mol/L纯水 | |
| C. | 使石蕊试液呈紫色的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LC2H2、C2H6的混合气体与22.4LC2H4中所含原子总数均为6NA | |
| B. | 常温下,1L PH=14的NaOH溶液中由水电离出的OH-个数为NA | |
| C. | 标准状况下,11.2L的12C16O和14N2的混合气体中所含中子数和原子数的差值为6NA | |
| D. | 将200mL0.1mol•L-1FeCl3溶液制成胶体,所得Fe(OH)3胶体粒子数为0.02NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com