
对于0.1 mol·L-1 Na2SO3溶液,正确的是( )
A.升高温度,溶液pH降低
B.c(Na+)=2c(SO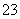 )+c(HSO
)+c(HSO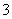 )+c(H2SO3)
)+c(H2SO3)
C.c(Na+)+c(H+)=2c(SO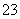 )+2c(HSO
)+2c(HSO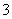 )+c(OH-)
)+c(OH-)
D.加入少量NaOH固体,c(SO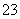 )与c(Na+)均增大
)与c(Na+)均增大
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法
已知:H2S(g)  H2(g)+
H2(g)+ S2(g)
S2(g)
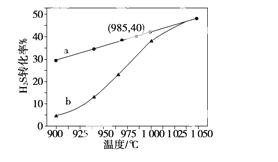
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985 ℃时H2S按上述反应分解的平衡常数K=________;说明随温度的升高,曲线b向曲线a逼近的原因:__________________________。
(2)CuBr2分解的热化学方程式为:
2CuBr2(s)  2CuBr(s)+Br2(g) ΔH=+105.4 kJ/mol
2CuBr(s)+Br2(g) ΔH=+105.4 kJ/mol
在密闭容器中将过量CuBr2于487 K下加热分解,平衡时p(Br2)为4.66×103 Pa。
①如反应体系的体积不变,提高反应温度,则p(Br2)将会_______________(填“增大”、“不变”或“减小”)。
②如反应温度不变,将反应体系的体积增加一倍,则p(Br2)的变化范围为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O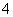 )
)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
现有常温时pH=1的某强酸溶液10 mL,下列操作能使溶液的pH变成2的是( )
A.加水稀释成100 mL
B.加入10 mL的水进行稀释
C.加入10 mL 0.01 mol/L的NaOH溶液
D.加入10 mL 0.01 mol/L的HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
用1.0 mol·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积V关系如右图所 示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是(
示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是( )
)
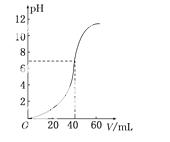
A.1 mol·L-160 mL
B.0.5 mol·L-1 80 mL
C.0.5 mol·L-1 60 mL
D.1 mol·L-1 80 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①豆浆和雾都是胶体 ②可用丁达尔现象区分溶液和胶体
③医疗上的血液透析利用了胶体的性质,而土壤保肥与胶体的性质无关 ④胶体微粒很小,可以透过半透膜 ⑤氢氧化铁胶体稳定存在的主要原因是胶粒带电荷
A.①②③ B.①②④ C.②⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO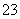
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO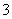 )+c(CO
)+c(CO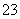 )
)
D. 温度升高,c(HCO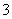 )增大
)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如图所示 。
。
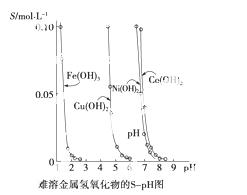
(1)pH=3时 溶液中铜元素的主要存在形式是________。
溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH____。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是_____________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:_______________________________________________________。
(5)已知一些难溶物的溶度积常数如下表。
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________( 填选项)。
填选项)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com