
| A. | ②⑤⑥ | B. | ④⑥⑦ | C. | ③④⑦ | D. | 以上都不正确 |
分析 ①制备Fe(OH)3胶体,通常是将饱和FeCl3溶液滴入沸水中,加热至溶液呈红褐色为止;
②实验中配制一定物质的量浓度溶液时,所选容量瓶规格应该等于或稍微大于所需溶液体积;
③为了除去硝酸钾溶液中含有的少量硝酸钡杂质,可以加入过量的碳酸钾溶液,过滤后除去沉淀,在滤液中加入适量硝酸调至溶液的pH为7;
④制取Fe(OH)2时,吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,防止生成的氢氧化亚铁被氧化;
⑤Ag能溶于稀硝酸中,不溶于氨水中;
⑥瓷坩埚中含有二氧化硅,二氧化硅能和NaOH反应;
⑦用分液漏斗分离互不相溶的溶液时,下层液体从下口倒出,上层液体从上口倒出.
解答 解:①制备Fe(OH)3胶体,通常是将饱和FeCl3溶液滴入沸水中,加热至溶液呈红褐色为止,不能长时间加热,否则会产生红褐色沉淀,故错误;
②实验中配制一定物质的量浓度溶液时,所选容量瓶规格应该等于或稍微大于所需溶液体积,所以配制950mL溶液需要1000mL容量瓶,故错误;
③为了除去硝酸钾溶液中含有的少量硝酸钡杂质,可以加入过量的碳酸钾溶液,过滤后除去沉淀,在滤液中加入适量硝酸调至溶液的pH为7,稀硝酸能除去过量的碳酸钾,故正确;
④制取Fe(OH)2时,氢氧化亚铁易被空气中氧气氧化生成氢氧化铁,为防止氢氧化亚铁被氧化,则吸取NaOH溶液的胶头滴管的末端应插入FeSO4溶液中,故正确;
⑤Ag能溶于稀硝酸中,不溶于氨水中,应该用稀硝酸洗涤做过银镜反应的试管,故错误;
⑥瓷坩埚中含有二氧化硅,二氧化硅能和NaOH反应生成硅酸钠和水,应该用铁坩埚,故错误;
⑦用分液漏斗分离互不相溶的溶液时,下层液体从下口倒出,为防止倒出的液体中含有杂质,则上层液体从上口倒出,故正确;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质制备、仪器洗涤、基本操作等知识点,明确物质性质及基本操作是解本题关键,注意:除杂时不仅要除去杂质且不能引进新的杂质,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4Cl是电解质,所以NH4Cl在溶液通电时可以电离 | |
| B. | Al(OH)3是两性氢氧化物,所以不能用过量的氨水与铝盐制备 | |
| C. | 在铝热剂上面加少量氯酸钾,并在混合物中间插一根镁条,点燃镁条,就能引发铝热反应 | |
| D. | Al(OH)3胶体的本质特征是能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
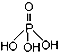 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液和稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 碳酸钾溶液与稀硫酸反应:CO32-+H+═CO2↑+H2O | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 实验室制取氧气:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2K++2Cl-+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )④
)④ ⑤葡萄糖⑥蛋白质.
⑤葡萄糖⑥蛋白质.| A. | ①③⑤ | B. | ②④⑥ | C. | ②③④ | D. | ①⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com