
| A、BaCl2溶液(稀硫酸) |
| B、氨水(醋酸溶液) |
| C、Ba(OH)2溶液[Ba(HCO3)2溶液] |
| D、Ba(OH)2溶液(NaHSO4溶液) |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A、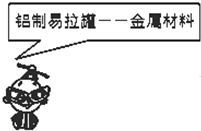 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Fe2+、Cl-、NO
| ||
| B、Na+、Ca2+、Cl-、CO32- | ||
C、Na+、SO42-、NH4+、HCO
| ||
D、Na+、K+、NO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向MgCl2溶液中加入石灰乳:Mg2++2OH-═Mg(OH)2↓ |
| B、磁性氧化铁溶于稀硝酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C、向NaAlO2的水溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| D、向NaHCO3溶液中加入过量的澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(A-)>c(HA) |
| B、c(Na+)+c(H+)=c(A-)+c(Cl-)+c(OH-) |
| C、c(HA)+c(A-)=0.1mol/L |
| D、c(Na+)=c(A-)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氧化硅是光纤制品的基本原料 |
| B、水玻璃可用作黏合剂和防火剂 |
| C、电解NaCl饱和溶液,可制得金属钠 |
| D、Al2O3的熔点很高,是一种耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、KClO3+6HCl=KCl+3Cl2↑+3H2O | ||||
B、2NaCl
| ||||
C、H2+Cl2
| ||||
| D、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+的物质的量为0.1mol | ||
B、倒出1 L溶液后,浓度变为原来的
| ||
| C、K+的物质的量浓度为0.1mol/L | ||
| D、含有0.2mol K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com