
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V1=30ml,
故答案为:30;10;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(2)小题,首先V1、V6的求得要注意分析表中数据;最后一问应该能够想到“覆盖”的问题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A.观察Fe(OH)2 的生成 | B.中和滴定 | C.除去CO2气体中 的HCl气体 | D.制取并收集干燥 的氨气 |
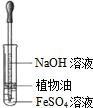 |  | 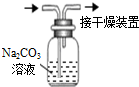 | 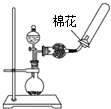 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:填空题
将下列物质按要求填空:①NaCl②汞③盐酸④BaSO4⑤干冰⑥H2SO4⑦葡萄糖⑧碘酒⑨液态氧气⑩熔融MgC12
(l)以上物质能导电的是____________________
(2)以上物质属于电解质的是__________________
(3)以上物质属于非电解质的是_____________
(4)以上物质溶于水后能导电的纯净物是________________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
判断下列有关化学基本概念的依据正确的是
A.溶液与胶体:本质区别是能否发生丁达尔效应
B.纯净物与混合物:是否仅含有一种元素
C.氧化还原反应:元素化合价是否变化
D.电解质与非电解质:物质本身的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
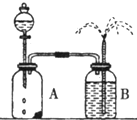 化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多.
化学反应速率的客观因素有许多,如温度、浓度、压强、催化剂、表面积等,因此探究客观条件与化学反应速率关系的实验设计及改进也就许许多多.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①Na2SO4粉末,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)=v(乙),则假设一不成立 ③若v(甲)<v(乙),则假设一成立 (填“>”、“=”或“<”) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
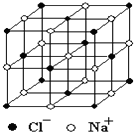 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL.回答下列问题:
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞.NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高.现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中.②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸 | B. | 溴水 | C. | KSCN溶液 | D. | 酸性高锰酸钾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com