
【题目】某些有机物的结构简式可用“键线式”表示,如(CH3)2CHCH3可用“![]() ”来表示。已知某环烷烃是平面结构,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,即“
”来表示。已知某环烷烃是平面结构,其结构如红十字协会的会徽,因此有人将它称为“红十字烷”,即“![]() ”,写出它的分子式________,当它发生一氯取代时,能生成________种沸点不同的产物。该红十字烷与乙烯(CH2===CH2)的关系为________。
”,写出它的分子式________,当它发生一氯取代时,能生成________种沸点不同的产物。该红十字烷与乙烯(CH2===CH2)的关系为________。
具有相同的分子式 B.具有相同的最简式 C.互为同系物 D.互为同分异构体
丙烯是乙烯的同系物,化学性质与乙烯相似,丙烯在一定条件下发生反应可生成高分子化合物。其方程式为_____________________________,丙烯与氢气加成后在与氯气取代生成的二氯代物的同分异构体数______________。
【答案】 C12H24 2 B  4
4
【解析】试题分析:“键线式”折点、端点若没有注明原子,则折点、端点为碳原子,每个碳原子能形成4个共价键;“红十字烷”结构对称,有2种不同环境的氢原子;根据乙烯、和 “红十字烷”的结构式、分子式分析二者关系;丙烯的结构简式为CH2=CH-CH3;
解析:“键线式”折点、端点若没有注明原子,则折点、端点为碳原子,每个碳原子能形成4个共价键,所以每个碳原子连有2个H原子,“红十字烷”分子式为C12H24;“红十字烷”结构对称,有2种不同环境的氢原子,所以一氯代物有2种;根据乙烯分子式C2H4、“红十字烷”的分子式是C12H24,乙烯含有碳碳双键为烯烃,“红十字烷”为环烷烃;分子式不同故A错误;最简式都是CH2 ,故B正确;结构不同,不属于同系物,故C错误; 分子式不同,不属于同分异构体,故D错误;丙烯的结构简式为CH2=CH-CH3含有碳碳双键能发生加聚反应生成聚丙烯,化学方程式为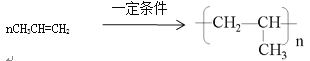 ;丙烯与氢气加成后生成丙烷,丙烷的二氯代物有1,1-二氯丙烷、1,2-二氯丙烷、1,3-二氯丙烷、2,2-二氯丙烷,共4种。
;丙烯与氢气加成后生成丙烷,丙烷的二氯代物有1,1-二氯丙烷、1,2-二氯丙烷、1,3-二氯丙烷、2,2-二氯丙烷,共4种。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列变化属于取代反应的是( )
A. 苯与溴水混合,水层褪色 B. 甲苯制三硝基甲苯
C. 乙醇在浓硫酸作用下制取乙烯 D. 苯和氯气在一定条件下生成六氯环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 同周期元素中,ⅠA族元素的原子半径最小
B. ⅥA 族元素的原子,其半径越大,越容易得到电子
C. 室温时,零族元素的单质都是气体
D. 所有主族元素的原子,形成单原子离子时的化合价和它的族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2014新课标2】37.[化学选修——3:物质结构与性质]
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
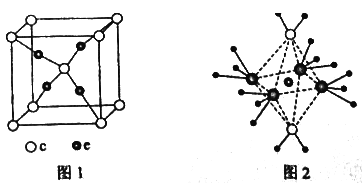
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃的分子式是C8H10,它可能有的同分异构体共_____种,将它们分别进行一硝化反应,得到产物分子式都是C8H9NO2,在含两甲基的同分异构体中,A进行一硝化反应得到两种产物,B得到三种产物,C只得到一种产物。由此可判断A、B、C是下列哪一种结构并命名。请将字母填入结构式后面的括号中,名称写在后面的横线上。
(1)![]() (______)_________________
(______)_________________
(2)![]() (______)_________________
(______)_________________
(3) (______)________________________
(______)________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。

已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H ②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用是___________________;若用同位素180示踪法确定反应产物水分子
中氧原子的提供者,写出能表示180位置的化学方程式:_____________________。
(2)球形干燥管C的作用是______________。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示)______________________;反应结束后D中的现象是_________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出___________;再加入(此空从下列选项中选择)________,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016北京卷】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
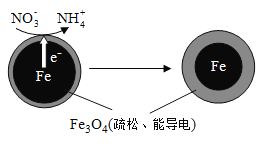
①作负极的物质是________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3—的去除率低。其原因是________。
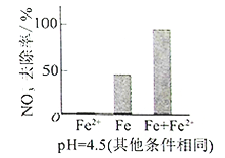
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3—的去除率。对Fe2+的作用提出两种假设:
Ⅰ. Fe2+直接还原NO3—;
Ⅱ. Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_______。
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4。结合该反应的离子方程式,解释加入Fe2+提高NO3—去除率的原因:______。
(4)其他条件与(2)相同,经1小时测定NO3—的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3—的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3—去除率和铁的最终物质形态不同的原因:__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com