
【题目】蒸馏实验操作方法,可以用于分离( )
A.气体混合物B.固体混合物
C.悬浊液里的固体和液体D.沸点相差较大的互溶液体
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9ClO的同分异构体中能与Na反应放出氢气的共有(不含立体异构)
A. 8 种 B. 9 种 C. 10 种 D. 12 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是
选项 | 甲 | 乙 | 丙 | 试管中现象 |
A | 浓盐酸 | 二氧化锰 | 石蕊溶液 | 先变红后褪色 |
B | 浓氨水 | 生石灰 | A1Cl3溶液 | 先沉淀后消失 |
C | 醋酸 | 碳酸钙 | BaC12溶液 | 变浑浊 |
D | 浓硝酸 | 铜 | 水 | 试管口出现红棕色 |
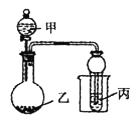
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
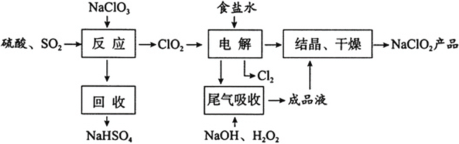
回答下列问题:
(1)NaClO2中Cl的化合价为________。
(2)写出“反应”步骤中生成ClO2的化学方程式____________________。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去杂质Ca2+和SO42-,要加入的除杂试剂顺序为_________、________。“电解”中阴极反应的主要产物是____________。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为________。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下:
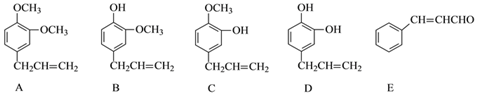
请回答下列问题:
(1)A的分子式为___________;这五种化合物中,互为同分异构体的是_________(填序号)。
(2)若E![]() X
X ![]() Y,且Y是D的同分异构体,写出反应①的化学方程式:__________________________,Y的结构简式为___________,反应③属于______反应。
Y,且Y是D的同分异构体,写出反应①的化学方程式:__________________________,Y的结构简式为___________,反应③属于______反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到相应目的是( )
选项 | A | B | C | D |
实验 过程 |
|
|
|
|
实验 目的 | 将乙二醇(HOCH2CH2OH) 转化为乙二酸(H2C2O4) | 比较氯化铁和二氧化锰对 H2O2 分解反应的催化效果 | 证明稀硝酸与铜反应时表现出氧化性 | 用 SO2 与 Ba(NO3)2 反 应获得 BaSO3沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为______________________________________该反应类型______________其中浓H2SO4的作用是_________________和_________________
[装置设计]甲、乙、丙三位同学分别设计下列三套实验装置
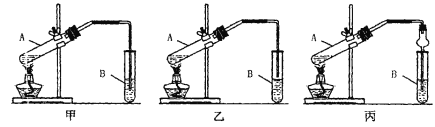
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__________(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是_____________
[实验步骤]①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4 充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验。
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查_________________
(2)试管B中饱和Na2CO3溶液的作用是_________________________
(3)从试管B中分离出乙酸乙酯的实验操作是__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若将等物质的量的 CO 和 H2 混合气体充入恒温恒容密闭容器中进行反应:CO(g)+2H2(g)![]() CH3OH(g),下列事实能说明此反应已达到平衡状态的是
CH3OH(g),下列事实能说明此反应已达到平衡状态的是
A. 容器内气体密度保持不变B. 混合气体的平均相对分子质量不变
C. 生成 CH3OH 的速率与生成 H2 的速率相等D. CO 的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L1 HA中逐滴加入0.1 mol·L1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是
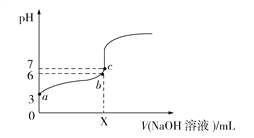
A. b点溶液中H2O电离出的H+浓度大于c点
B. Ka(HA)=106
C. b点溶液中有c(A)c(Na+)=9.9×107 mol·L1
D. c点溶液中的微粒只有A、OH、H+、Na+和H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com