
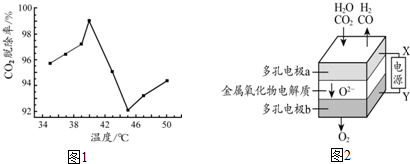
分析 (1)利用氨水作吸收液是当前有效捕捉CO2的方法,经过可逆反应生成NH4HCO3,据此写出反应的化学方程式;
(2)NH4HCO3溶液显碱性,则c(OH-)>c(H+),说明铵根离子的水解程度小于碳酸氢根离子的水解程度,则c(NH4+)>c(HCO3-),然后结合物料守恒、电荷守恒进行判断各离子浓度大小;
(3)根据氨气与水二氧化碳的反应为放热反应分析;
(4)①电解池阳极发生氧化反应,阴极发生还原反应,根据与X极相连的电极产生的气体判断;电解池阴极发生还原反应,根据反应物结合化合价的变化分析;
②根据图示知:阴极产生H2、CO,阳极产生氧气,结合电极总反应计算;
(5)NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1①
NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ.mol-1②
将方程式②+①3NO(g)+O3(g)=3NO2(g),焓变进行相应的改变;
(6)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式;
(7)根据CaSO3+SO42-=CaSO4+SO32-知,加入硫酸钠导致亚硫酸根离子浓度增大,浓度越大反应速率越大.
解答 解:(1)氨水作吸收液捕捉CO2,经过可逆反应生成NH4HCO3,反应的化学方程式为:CO2+NH3•H2O?NH4HCO3,
故答案为:CO2+NH3•H2O?NH4HCO3;
(2)NH4HCO3溶液显碱性,则c(OH-)>c(H+),说明铵根离子的水解程度小于碳酸氢根离子的水解程度,则c(NH4+)>c(HCO3-),
a.铵根离子的水解程度小于碳酸氢根离子的水解程度,则c(NH3•H2O)<c(H2CO3),故a错误;
b.根据分析可知:c(NH4+)>c(HCO3-)>c(OH-)>c(H+),故b正确;
c.根据碳酸氢铵溶液中的物料守恒可得:c(NH3•H2O)+c(NH4+)=c(H2CO3)+c(HCO3-)+c(CO32-),故c错误;
d.根据碳酸氢铵溶液中的电荷守恒可得:c(HCO3-)+2c(CO32-)+c (OH-)=c (H+)+c (NH4+),故d正确;
故答案为:ac;
(3)由于氨水吸收CO2为放热的可逆反应,所以在40~45℃时,由于升高温度平衡向左移动,导致CO2 脱除率降低,
故答案吴娜:氨水吸收CO2为放热反应,在40~45℃升高温度平衡向左移动,使CO2 脱除率降低;
(4)①根据图示知:与X相连的电极产生CO,电解H2O-CO2混合气体,二氧化碳得到电子生成一氧化碳,发生还原反应,电解池阴极发生还原反应,所以X是电源的负极;
电解池阴极发生还原反应,电解H2O-CO2混合气体制备H2和CO,阴极:水中的氢原子得到电子生成氢气,H2O+2e-═H2↑+O2-,二氧化碳得到电子生成一氧化碳:CO2+2e-═CO+O2-,
故答案为:负极;CO2+2e-=CO+O2-;
②电解H2O-CO2混合气体制备H2和CO,根据图示知:阴极产生H2、CO,阳极产生氧气,所以总反应为:H2O+CO2$\frac{\underline{\;电解\;}}{\;}$H2+CO+O2,阴极产生H2、CO,阳极产生氧气,阴、阳两极生成的气体的物质的量之比是2:1,
故答案为:2:1;
(5)NO(g)+O3(g)═NO2(g)+O2(g)△H=-200.9kJ.mol-1 ①
NO(g)+$\frac{1}{2}$O2(g)═NO2(g)△H=-58.2kJ.mol-1②
将方程式2②+①3NO(g)+O3(g)=3NO2(g),所以△H=2×(-58.2kJ.mol-1)+(-200.9kJ.mol-1)=-317.3kJ/mol,
故答案为:-317.3;
(6)溶液pH约为8,说明溶液呈碱性,SO32-将NO2转化为NO2-,同时SO32-被氧化生成SO42-,根据反应物和生成物书写离子方程式为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O,
故答案为:SO32-+2NO2+2OH-=SO42-+2NO2-+H2O;
(7)CaSO3根据CaSO3(s)?Ca2+(aq)+SO32-(aq)知,加入硫酸钠,SO42-结合Ca2+,c(Ca2+)降低,使上述平衡向右移动,导致c(SO32-)增大,浓度越大反应速率越大,所以加快反应速率,提高NO2的吸收速率,
故答案为:CaSO3(s)?Ca2+(aq)+SO32-(aq),加入Na2SO4溶液,SO42-结合Ca2+,c(Ca2+)降低,使上述平衡向右移动,c(SO32-)增大,提高NO2的吸收速率.
点评 本题考查较为综合,涉及反应速率影响因素、氧化还原反应离子方程式的书写、盖斯定律的计算、离子浓度大小比较等知识点,题目难度中等,试题综合性较强,侧重考查学生分析计算能力,注意掌握常见物质的性质、离子方程式书写规则.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液操作时分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液小火加热蒸干 | |
| C. | 利用蒸馏的方法进行乙醇与水的分离时,温度计水银球应放在液面以下来准确测定温度 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
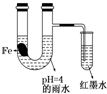 如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释不合理的是( )
如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面.以下有关解释不合理的是( )| A. | 生铁片中所含的碳能增强铁的抗腐蚀性 | |
| B. | 雨水酸性较强,生铁片开始发生析氢腐蚀 | |
| C. | 导管内墨水液面回升时,正极反应式:O2+2H2O+4e-═4OH- | |
| D. | 随着反应的进行,U型管中雨水的酸性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCN中碳元素化合价为+2价 | |
| B. | NaCN中含有离子键和极性共价键 | |
| C. | H2O2既做氧化剂又做还原剂 | |
| D. | 当有0.1 mol NH3生成时,有0.2 mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测定中和热时,大小两烧杯间填满碎纸的作用是固定小烧杯 | |
| B. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下口放出 | |
| C. | NaCl溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量液体即停止加热 | |
| D. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的$\frac{1}{3}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com