
| 时间/s | 0 | 20 | 40 | 60 | 80 | 100 |
| n(A)/mol | 0.40 | - | 0.20 | - | - | 0.10 |
| n(B)/mol | 0.00 | 0.24 | - | 0.52 | 0.60 | 0.60 |
| A. | 0~40 s的平均反应速率v(B)=0.01 mol•L-1•s-1 | |
| B. | 80 s时容器中混合气体的密度小于40 s时混合气体的密度 | |
| C. | 其他条件不变,加入合适的催化剂,0~80 s时间段内v(A)>0.001 875 mol•L-1•s-1 | |
| D. | 反应达到最大限度后,增加A的浓度,B的生成速率不变 |
分析 A.反应速率v=$\frac{△c}{△t}$,0~40 s内A变化物质的量为0.2mol,生成B物质的量为0.4mol,据此计算反应速率;
B.固定容积的密闭容器中反应前后气体体积不变,气体质量守恒,依据ρ=$\frac{m}{V}$计算分析;
C.0-80s反应达到平衡状态,催化剂改变反应速率但不改变化学平衡;
D.反应达到最大限度后,增加A的浓度,相当于增大体系压强,平衡逆向进行.
解答 解:A.反应速率v=$\frac{△c}{△t}$,0~40 s内A变化物质的量为0.2mol,生成B物质的量为0.4mol,据此计算反应速率v(B)=$\frac{\frac{0.4mol}{2L}}{40s}$=0.005mol/L•s,故A错误;
B.固定容积的密闭容器中反应前后气体体积不变,气体质量守恒,依据ρ=$\frac{m}{V}$计算分析密度始终不变,故B错误;
C.0-80s反应达到平衡状态,催化剂改变反应速率但不改变化学平衡,80s内B变化的物质的量为0.6mol,则A变化物质的量为0.3mol,A表示的反应速率v(A)=$\frac{\frac{0.3mol}{2L}}{80s}$=0.001 875 mol•L-1•s-1,加入催化剂会同等程度加快正逆反应速率,v(A)>0.001 875 mol•L-1•s-1 ,故C正确;
D.反应达到最大限度后,增加A的浓度,相当于增大体系压强,平衡逆向进行,B的生成速率增大,故D错误;
故选C.
点评 本题考查了化学反应速率概念的计算、影响因素分析判断,注意恒容容器中气体密度不变,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NCl3和SiO32-的中心原子的杂化方式相同,都是sp3杂化 | |
| B. | 分子构型为平面三角形 | |
| C. | NCl3比NBr3易挥发 | |
| D. | NC13是极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视刻度线,会使所配溶液浓度偏高 | |
| C. | 二氧化硅不与强酸反应,可用石英作为反应容器制取氢氟酸 | |
| D. | 燃着的镁条伸入盛满二氧化碳的集气瓶中,不能继续燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
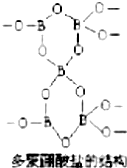 有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )
有一种多聚硼酸盐为无限空间网状结构,图为其结构单元示意图.其结构的基本单元可表示为(B5On)m-,则m、n的值分别为( )| A. | 3,9 | B. | 2,4 | C. | 2,5 | D. | 3,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.
Ⅰ.氢能的存储是氢能应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:D>C>B | |
| B. | B的氢化物比C的氢化物更稳定 | |
| C. | C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA | |
| D. | 由A、B、C形成的化合物一定只有共价键没有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | 离子半径:Z>Y>X>W | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X、Y、Z的气态氢化物中,Z的熔点最高 | |
| D. | X元素的一种氢化物含极性键和非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用干燥洁净的玻璃棒蘸取NaClO溶液,滴到表面皿上的pH试纸上测pH | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| C. | 取金属钠时,要先用镊子夹取,再用小刀切下所需量,剩余钠不能放回原试剂瓶中 | |
| D. | 用NaOH标准溶液滴定盐酸,滴定管尖嘴部分若在滴定前无气泡,滴定终点时出现气泡,测定结果将偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com