
| V |
| Vm |
| n |
| V |
| 0.112L |
| 22.4L/mol |
| 0.005mol |
| 0.5L |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
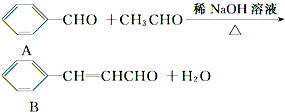
查看答案和解析>>
科目:高中化学 来源: 题型:
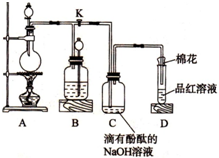 为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验,请回答:
为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
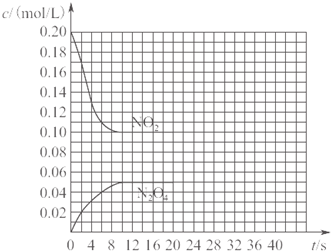 在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示.
在30℃时,将0.40mol的二氧化氮气体充入2L抽空的密闭容器中,经过10s达到平衡,浓度变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
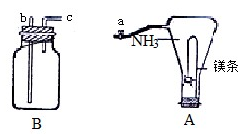 全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应:
全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应:| 点燃 |
| 点燃 |
| nMg(NH2)2 |
| nMgNH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
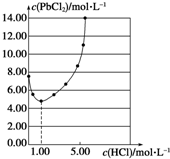 25℃时,PbCl2固体在不同浓度盐酸中的溶解度如图.在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )
25℃时,PbCl2固体在不同浓度盐酸中的溶解度如图.在制备PbCl2的实验中,洗涤PbCl2固体最好选用( )| A、蒸馏水 |
| B、1.00 mol?L-1盐酸 |
| C、5.00 mol?L-1盐酸 |
| D、10.00 mol?L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com