
一定条件下,恒容的密闭容器中,加入一定量的A与B发生反应:A(s)+2B(g) C(g)+2D(g)
ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
C(g)+2D(g)
ΔH<0,平衡时C的物质的量与加入B的物质的量的变化关系如图所示。下列说法正确的是( )
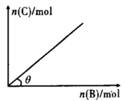
A.增加A的物质的量,正反应速率加快
B.平衡时,其他条件不变,当温度升高时,θ变大
C.图中曲线的斜率表示反应的化学平衡常数
D.平衡时,其他条件不变,再通人B,则反应混合物的温度升高
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2011-2012学年山西省高三上学期第二次阶段性测试化学试卷 题型:填空题
(11分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:
请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
CH3O(H(g)。若在恒容密 闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是
(填字母)。
a.容器内压强保持不变 b.容器内气体密度保持不变
c.c(CO)=c(CH3OH) d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式: 。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是 。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为 。
(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛 g(精确到0.1,下同),甲醇厂CO的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com