
【题目】浓度均为0.01molL-1的盐酸(A)、醋酸溶液(B)、氢氧化钠溶液(C):
(1)写出B溶液中醋酸的电离方程式:______________。上述溶液稀释10倍后pH减小的是______________(填字母)。
(2)取等体积的A、B两溶液分别加入过量的锌粉,反应开始时放出H2的速率依次为a1、a2,则a1______________(填“>”“<”或“=”,下同)a2。反应结束时放出H2的物质的量为n1、n2,则n1______________n2。
(3)完全中和体积与物质的量浓度均相同的两份C溶液时,需A、B两溶液的体积依次为V1、V2则V1______________V2;若完全中和体积与pH均相同的A、B两溶液时消耗C溶液的体积分别为V(A)、V(B),则V(A)______________V(B)。
(4)图中M点表示25℃时水在电离平衡时的离子浓度N点表示T℃时水在电离平衡时的离子浓度。T℃时,3×10-3molL-1的氢氧化钠溶液与1×10-3molL-1盐酸等体积混合后溶液的pH=______________。
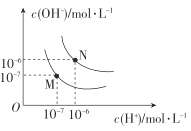
【答案】CH3COOH![]() CH3COO-+H+ C > = = < 9
CH3COO-+H+ C > = = < 9
【解析】
(1)醋酸是弱电解质,醋酸的电离可逆;加水稀释,酸的pH升高、碱溶液的pH降低;
(2)0.01molL-1的盐酸中氢离子浓度大于0.01molL-1的醋酸;同浓度、同体积的盐酸、醋酸中溶质的物质的量相同;
(3)完全中和体积与物质的量浓度均相同的两份氢氧化钠溶液时,消耗盐酸、醋酸的物质的量相等;pH均相同的盐酸、醋酸,醋酸浓度大于盐酸;
(4)N点表示T℃时水的离子积,则T℃时水的离子积常数是10-12;
(1)醋酸是弱电解质,醋酸的电离方程式是CH3COOH![]() CH3COO-+H+;盐酸、醋酸的pH小于7,加水稀释pH增大;氢氧化钠溶液的pH大于7,加水稀释pH减小,故选C;
CH3COO-+H+;盐酸、醋酸的pH小于7,加水稀释pH增大;氢氧化钠溶液的pH大于7,加水稀释pH减小,故选C;
(2)0.01molL-1的盐酸中氢离子浓度大于0.01molL-1的醋酸,氢离子浓度越大,反应速率越快,所以a1>a2;同浓度、同体积的盐酸、醋酸中溶质的物质的量相同,所以和锌反应放出氢气的物质的量相等,则n1=n2;
(3)完全中和体积与物质的量浓度均相同的两份氢氧化钠溶液时,消耗盐酸、醋酸的物质的量相等,盐酸、醋酸的浓度相等,所以V1=V2;pH均相同的盐酸、醋酸,醋酸浓度大于盐酸,体积与pH均相同的盐酸、醋酸两溶液,醋酸的物质的量大于盐酸,完全中和消耗氢氧化钠的体积醋酸大于盐酸,所以V(A) <V(B);
(4)T℃时水的离子积常数是10-12;T℃时,3×10-3molL-1的氢氧化钠溶液与1×10-3molL-1盐酸等体积混合,氢氧化钠有剩余,溶液中![]() =1×10-3molL-1,
=1×10-3molL-1,![]() 1×10-9molL-1,pH=9。
1×10-9molL-1,pH=9。


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】恒温恒压条件下,1 mol M气体和1 mol N气体在密闭容器中发生反应: M(g) +3N(g)2Q(g)。下列说法可以判定反应达到平衡状态的是
A.![]() 正(M)=2
正(M)=2![]() 逆(Q)B.c(N):c(Q)=3:2
逆(Q)B.c(N):c(Q)=3:2
C.M的体积分数不再发生变化D.混合气体的密度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用CO和H2合成再生能源甲醇,反应为:2H2(g)+CO(g)![]() CH3OH(g) ΔH<0
CH3OH(g) ΔH<0
(1)一定温度下,将1molCO与1molH2通入VL恒容密闭容器中发生反应。
①该反应能自发进行的条件是______(填“高温”、“低温”或“任意温度”)
②下列说法正确的是______。
A.v正(H2)=2v逆(CO)时,反应达到化学平衡状态
B.达到平衡时CO与H2的转化率相等
C.恒温恒压,往原料气中通入少量稀有气体,CO的转化率会降低
D.该反应的正反应活化能大于逆反应活化能
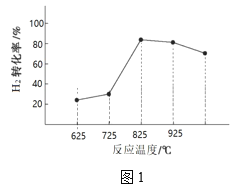
③图1为温度对H2合成甲醇反应的影响,请从反应速率和平衡的角度分析725℃以后H2百分含量随时间增长呈现该变化趋势的原因______。
(2)在恒温T、恒压P的条件下,将3.0molCO与4.5molH2通入容积可变的密闭容器中。达平衡时容器的体积为2L,CO的转化率为50%。
①此反应的正、逆反应速率与浓度的关系为v正=k正c(CO)·c2(H2),v逆=k逆c(CH3OH),其中k正、k逆为速率常数。在温度T下k正、k逆的关系式为k正=_____k逆。
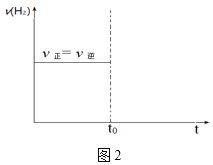
②若平衡时,在t0时刻再向容器中通入9.0molCO,在图2中画出充入CO后的v正、v逆随时间变化的图像_____。
(3)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,请写出生成甲醇的电极反应式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。
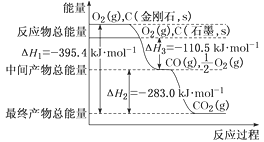
(1)在通常状况下,金刚石和石墨相比较,___(填“金刚石”或“石墨”)更稳定。
(2)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497kJ·mol-1。N2(g)+O2(g)=2NO(g) ΔH=+180.0kJ·mol-1。NO分子中化学键的键能为___kJ·mol-1。
(3)综合上述有关信息,请写出用CO除去NO的热化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铂—铑合金网上发生反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。该反应是一个自发的反应且铂—铑合金网未预热也会发热,下列像图不正确的是
4NO(g)+6H2O(g)。该反应是一个自发的反应且铂—铑合金网未预热也会发热,下列像图不正确的是
A.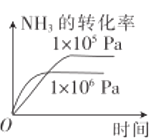 B.
B.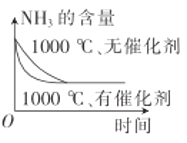
C. D.
D.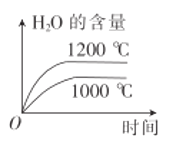
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应:11P+15CuSO4+24H2O==5Cu3P+6H3PO4+15H2SO4中,7.5 mol CuSO4可氧化磷原子的物质的量为( )
A.1.5 mol B.3 mol C.5 mol D.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中短周期的一部分,若A原子最外层的电子数比次外层少3,则下列说法正确的是( )
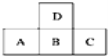
A.只有A的单质存在同素异形体
B.D的最高正价比A大
C.A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C<B<A
D.离子半径的大小顺序是A>B>C>D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由Al、CuO、Fe2O3组成的混合物共10.0g,放入500mL某浓度的盐酸中,混合物完全溶解,当再加入250mL 2.00mol/L的NaOH溶液时,得到沉淀最多。上述盐酸的浓度为( )
A. 1.00 mol/LB. 0.500 mol/L
C. 2.00 mol/LD. 3.00 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.
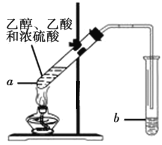 ℃
℃
(1)写出实验室制备乙酸乙酯的化学方程式_________
(2)步骤②中b试管中饱和Na2CO3溶液的主要作用_______(填字母)
a.降低乙酸乙酯的溶解度
b.除去实验中挥发出来的硫酸
c.除去乙酸乙酯中混有的乙酸和乙醇
(3)试管b中盛放的试剂_________(填“能”或“不能”)换成NaOH溶液
(4)连接好装置(装置气密性良好),用小火均匀地加热装有混合液的试管a3~5min,需要用小火均匀加热,其主要原因是________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com