
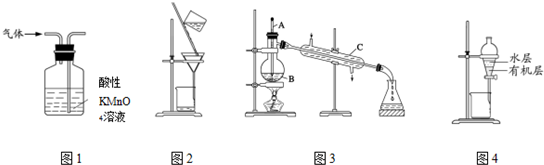
| A. | 用图1所示装置可除去甲烷中乙烯杂质 | |
| B. | 用图2所示装置分离硫酸铜溶液和铜 | |
| C. | 用图3所示装置分离乙醇和水 | |
| D. | 用图4所示装置分离苯萃取碘水后已分层的有机层和水层 |
分析 A.乙烯被高锰酸钾氧化生成二氧化碳;
B.Cu不溶于水;
C.乙醇和水互溶,但沸点不同,可利用蒸馏法分离,温度计测定馏分的温度,冷却水下进上出;
D.苯萃取碘水后,苯密度比水的密度小,有机层在上层.
解答 解:A.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质,不能除杂,试剂应为溴水,故A错误;
B.Cu不溶于水,则利于图中过滤装置可分离,故B正确;
C.由图可知,温度计的水银球没在支管口处,冷却水下没有进上出,均不合理,故C错误;
D.苯萃取碘水后,苯密度比水的密度小,有机层在上层,图中水层应在下方,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离方法、实验装置的作用、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
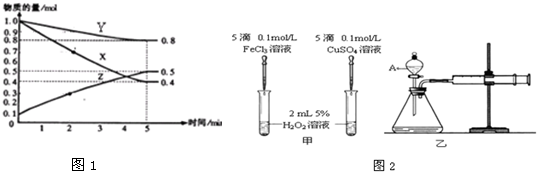
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等,达到化学平衡 | |
| D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2和 SiO2 | B. | NaCl 和 HCl | ||
| C. | (NH4)2CO3和 CO(NH2)2(尿素) | D. | NaH 和 KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
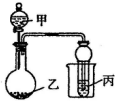 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 饱和食盐水 | 电石 | 酸性 KMnO4溶液 | 紫色褪去 | 乙炔发生氧化反应 |
| B | 稀盐酸 | 碳酸钠 | 澄清石灰水 | 溶液变浑浊 | 非金属性 Cl>C |
| C | 醋酸 | 碳酸钠 | 澄清石灰水 | 变浑浊 | 醋酸酸性强于碳酸 |
| D | 浓氨水 | 生石灰 | CuSO4溶液 | 蓝色略变深 | NH3与 CuSO4溶液不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:填空题
今有①CH3COOH ②HCl ③H2SO4三种溶液。根据要求回答下列问题:
(1)当它们pH相同时,其物质的量浓度最大的是 (填序号)
(2)当它们的物质的量浓度相同时,其pH最小是 (填序号)
(3)将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为 (填序号)。
(4)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为 ;此时所得到的三种溶液的pH大小关系为 .
(5)若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
(6)FeCl3可做净水剂,净水原理是 (用离子方程式表达),FeCl3溶液中的离子浓度从大到小顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10个 | B. | 20个 | C. | 40个 | D. | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com