
由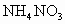 和
和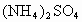 的混合物形成水溶液,经测定a L.该混合液与某浓度的氢氧化钠溶液反应时,当消耗占b mol NaOH时,刚好使
的混合物形成水溶液,经测定a L.该混合液与某浓度的氢氧化钠溶液反应时,当消耗占b mol NaOH时,刚好使 全部逸出;若a L该混合液与某浓度的
全部逸出;若a L该混合液与某浓度的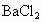 溶液反应,当消耗
溶液反应,当消耗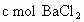 时,刚好沉淀完全.则该混合溶液中,
时,刚好沉淀完全.则该混合溶液中,
(1)原混合液中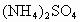 的物质的量浓度为_______________.
的物质的量浓度为_______________.
(2)原混合液中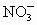 的物质的量为________________________.
的物质的量为________________________.
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 写出相应的离子方程式 |
| ①取试样加入足量10%的NaOH溶液,充分振荡后再将反应混合物倒入蒸馏烧瓶中蒸馏得到乙醇、水的混合物和产品A | 1OH-+C6H5-OH→C6H5O-+H2O OH-+C6H5-COOH→C6H5-COO-+H2O OH-+C6H5-COOH→C6H5-COO-+H2O |
| ②向步骤①的馏分中加入足量的生石灰,再次蒸馏浓缩,蒸气冷凝后得乙醇. | CaO+H2O=Ca(OH)2 |
| ③向产品A中通入足量CO2,静置后分液得 苯酚(C6H5-OH) 苯酚(C6H5-OH) 和溶液B. |
C6H5O-+CO2+H2O→C6H5OH+HCO3- C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| ④再向溶液B中加入足量 盐酸 盐酸 、静置、过滤后可得苯甲酸. |
C6H5COO-+H+→C6H5COOH↓ C6H5COO-+H+→C6H5COOH↓ |

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 11.82g |
| 197g/mol |
| 11.82g |
| 197g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ④ | ||||||
| 3 | ⑤ | ③ | ⑥ | ⑦ | ||||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.106 g B.53 g C.26.5 g D. ![]() g?
g?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com