
| A. | 4 | B. | 6 | C. | 5 | D. | 7 |
分析 方程式aCH4+bO2$\stackrel{点燃}{→}$cH2O+dCO2中甲烷中的C化合价由-4价升高为二氧化碳中的+4价,氧气中O由0价降低为-2价,依据氧化还原反应中得失电子守恒规律结合原子个数守恒配平方程式,据此解答.
解答 解:方程式aCH4+bO2$\stackrel{点燃}{→}$cH2O+dCO2中甲烷中的C化合价由-4价升高为二氧化碳中的+4价,氧气中O由0价降低为-2价,依据氧化还原反应中得失电子守恒规律结合原子个数守恒,反应方程式:1CH4+2O2$\stackrel{点燃}{→}$2H2O+1CO2,则a=1,b=2,c=2,d=1,化学计量数之和等,6,
故选:B.
点评 本题考查了氧化还原反应方程式配平,准确判断元素化合价变化情况,明确氧化还原反应中得失电子守恒规律是解题关键,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:填空题
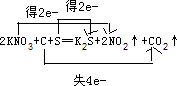 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的性质较活泼,难提炼,商代不可能有铝制品 | |
| B. | 铝的质地较软,易变形,不宜做碗 | |
| C. | 铝元素易导致老年痴呆,不宜盛放食物 | |
| D. | 铝的导热性较强,不宜做碗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠溶液:H+、Fe3+、SO42-、CH3COOH | |
| B. | 烧碱溶液:K+、HSO3-、NO3-、NH3•H2O | |
| C. | 空气:HCl、CO2、SO2、NO | |
| D. | 氢氧化铁胶体:H+、K+、S2-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 保证食品安全、保持营养均衡,是保障人体健康的基础.
保证食品安全、保持营养均衡,是保障人体健康的基础.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com