
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.
| ||
| 0.025L |


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
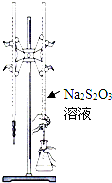 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| 充电 |
| ||
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
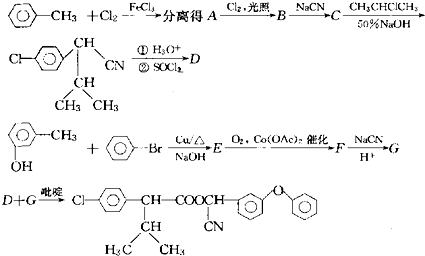
| ①H3O+ |
| ②SOCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
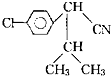
 (其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如图所示的转化过程:
(其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如图所示的转化过程: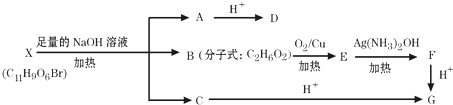
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、①③④⑤ |
| C、③④⑤⑥ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸和浓盐酸敞口存放浓度均变小 |
| B、将单质铁和铜分别与单质硫加热反应均生成低价硫化物(FeS和Cu2S) |
| C、在过氧化氢水溶液中加入二氧化锰、在盛有锌粒和稀硫酸的溶液中滴加硫酸铜溶液,产生气体的速率均加快 |
| D、将氯化铝溶液和碳酸氢钠溶液分别用酒精灯加热蒸干,然后灼烧,最后均得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CCl4可由CH4制得,可萃取碘水中的碘 |
| B、石油和天然气的主要成分都是碳氢化合物 |
| C、苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D、淀粉和纤维素的化学式都为(C6H10O5)n,但不是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:Na2CO3<NaHCO3 |
| B、等质量时与盐酸反应产生CO2的质量:Na2CO3<NaHCO3 |
| C、常温时水溶解性:Na2CO3<NaHCO3 |
| D、相对分子质量:Na2CO3<NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com