
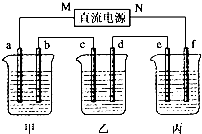
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
| ||
| 0.3×22.4 |
| 4 |
| 64×0.3 |
| 2 |


科目:高中化学 来源: 题型:
| A、只有①③ | B、①②④⑤ |
| C、①②③④ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠投入水中 |
| B、石墨在高温高压下转化为金刚石 |
| C、干冰汽化 |
| D、氯化铵受热会挥发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
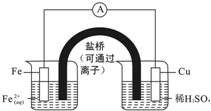
| A、电子由Cu电极流向Fe电极 |
| B、盐桥中的阳离子移向左池 |
| C、Fe电极为负极,Cu电极为正极 |
| D、Cu电极的电极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 精制盐、碘酸钾(以I计,18-33mg/kg) |
| 食用方法 | 烹饪时加入,菜熟后最佳 |
| 保存方法 | 密封避光,常温防潮 |
| A、此食盐是混合物 |
| B、“烹饪时加入,菜熟后最佳”的原因可能是碘酸钾受热不稳定 |
| C、碘酸钾(KIO3)中碘的化合价+5 |
| D、1kg此食盐中含碘酸钾(18-33)mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③⑤ | B、①④⑤ |
| C、②③⑥ | D、③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com