
| A、2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O |
| B、Zn+2HCl═ZnCl2+H2↑ |
| C、NaOH+HCl═NaCl+H2O |
| D、CuO+2HCl═CuCl2+H2O |
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
| A、CH3COONa(固体) |
| B、水 |
| C、硫酸钾溶液 |
| D、硝酸钠(固体) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就不再向环境排放该种有害物质.例如铬的化合物有以下循环关系:
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就不再向环境排放该种有害物质.例如铬的化合物有以下循环关系:| A、上述物质中只有Na2CrO4可作氧化剂 |
| B、发生反应⑤,一定要加入氧化剂 |
| C、发生反应①时,消耗Na2Cr2O7与转移的电子的物质的量之比为1:6 |
| D、从反应②来看,CrCl3不能用Cr(OH)3与盐酸反应来制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向氨水中加水稀释后,溶液中除了H2O以外所有微粒浓度都下降 |
| B、25℃时,将10mL pH=a的盐酸与100mL pH=b的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
| C、等物质的量浓度的NaCl溶液和CH3COONa溶液等体积混合,则混合溶液中离子浓度大小关系为:c(C1-)>c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D、等体积等物质的量浓度的NaX和弱酸HX混合后的溶液显碱性,则混合溶液中微粒浓度大小关系为:c(X-)>c(Na+)>c(HX)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeSO4在反应中作氧化剂 |
| B、该反应在水溶液中进行 |
| C、Na2O2既是氧化剂又是还原剂 |
| D、Na2FeO4中铁元素+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 催化剂 |

| 高温高压 |
| 催化剂 |
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol?L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L-1) | ρ1 | ρ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:
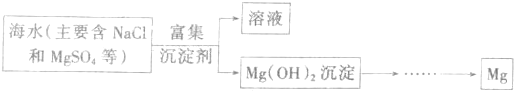
| 观点 | 是否正确 | 简述理由 |
| 学生1 | 否 | |
| 学生2 | ||
| 学生3 |
| △ |
| 电解 |
| 2800℃ |
| △ |
| C真空 |
| 1352℃ |
| ①过量盐酸 |
| ②△ |
| 电解 |
| 714℃ |
| 盐酸 |
| 活泼金属 |
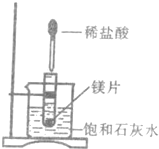
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com