
分析 (1)C2H2分子中含有一个C≡C和2个C-H;单键中含有一个σ键,三键中含有一个σ键和2个π键;
(2)由中心原子的价层电子对数判断;分子结构对称电荷中心重叠的分子为非极性分子;
(3)价层电子对=σ 键电子对+中心原子上的孤电子对,根据孤电子对数判断分子的实际构型.
解答 解:(1)C2H2分子中含有一个C≡C和2个C-H,则C2H2分子的结构式为H-C≡C-H;单键中含有一个σ键,三键中含有一个σ键和2个π键,则H-C≡C-H中含有3个σ键 2个π键;
故答案为:H-C≡C-H;3个、2个;
(2)CH2Cl2分子C原子形成4个σ键,没有孤电子对,价层电子对数为4,属于sp3杂化;CH2Cl2分子不结构对称电荷中心不重叠为极性分子;
故答案为:sp3;是;
(3)PCl3分子中P原子的价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,分子的VSEPR模型构型为四面体形,含有一个孤电子对,分子的实际构型为三角锥形;
故答案为:四面体形;三角锥形.
点评 本题考查了共价键的类型、有机物的结构、微粒空间构型的判断,题目难度不大,先根据价层电子对判断VSEPR模型,去掉孤电子对就是其实际空间构型,这是高考的热点、学习的重点.


科目:高中化学 来源: 题型:选择题
| A. | 铁溶于稀硝酸中:Fe+2H+=Fe2++H2↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | 少量CO2通入苯酚钠溶液中:2C6H5O-+CO2+H2O=2C6H5OH+CO32- | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ | |
| B. | FeCl3溶液中加少量Na2S溶液:2Fe3++S2-=2Fe2++S↓ | |
| C. | 向硫酸铜溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
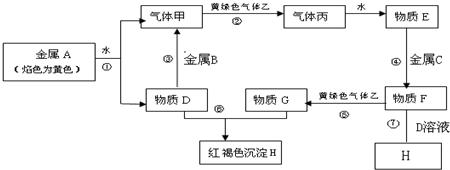
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OH-的电子式: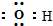 | |
| B. | F-的结构示意图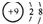 | |
| C. | N2的结构式: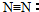 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应① | 反应② |
| A | 向AgNO3溶液中滴加稀盐酸 | AgNO3溶液与食盐水混合 |
| B | 过量CO2通入NaOH溶液中 | 过量CO2通入澄清石灰水中 |
| C | 向烧碱溶液中滴加稀盐酸 | 向H2SO4溶液中滴加KOH溶液 |
| D | 向BaCl2溶液中滴加稀硫酸 | 向Ba(OH)2溶液中滴加CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Cl2与常温下氢氧化钠溶液充分反应时转移的电子数为2NA | |
| B. | 1molCu与足量的硫固体反应转移的电子数为NA | |
| C. | 常温下,1 L 0.1 mol/L MgCl2溶液中含Mg2+数为0.1NA | |
| D. | 标准状况下,2.24L三氧化硫所含分子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com