
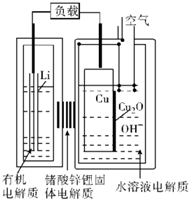
 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池放电时的反应过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,Cu作电池的负极 | |
| C. | 通空气时,铜被氧化,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
分析 放电时,锂失电子作负极,Cu上O2得电子作正极,负极上电极反应式为Li-e-═Li+,正极上电极反应式为Cu2O+H2O+2e-=2Cu+2OH-,电解质溶液中阳离子向正极移动,阴离子向负极移动,据此分析解答.
解答 解:A.放电时,阳离子向正极移动,则Li+透过固体电解质向Cu极移动,故A正确;
B.放电时,锂失电子作负极,Cu上O2得电子作正极,故B错误;
C.放电过程为2Li+Cu2O+H2O═2Cu+2Li++2OH-,正极上Cu2O反应,碱性条件下通空气时,铜被氧化表面产生Cu2O,故C正确;
D.通空气时,铜被腐蚀,表面产生Cu2O,放电时Cu2O转化为Cu,则整个反应过程中,铜相当于催化剂,故D正确;
故选B.
点评 本题考查了原电池原理,明确原电池负极上得失电子及电极反应式是解本题关键,题目难度中等,注意把握Cu在整个过程中的作用.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
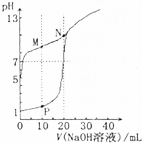
| A. | HX是弱酸,其c(OH-)是该盐酸中c(OH-)的104倍 | |
| B. | N点的pH>7的原因是由于NaOH过量所致 | |
| C. | M点c(HX)<c(X-) | |
| D. | P点c(Cl-)=0.05mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.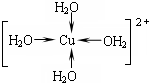 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH+4)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 | |
| D. | 将pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合,所得溶液的pH一定大于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
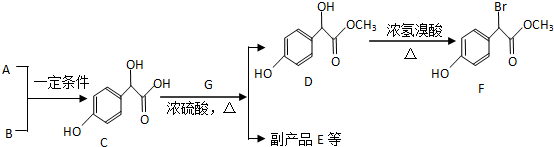
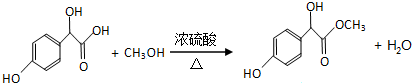
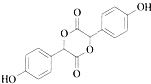 .
.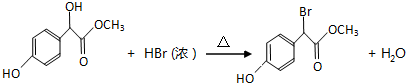
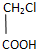
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把绿豆大的钾投入水中 | |
| B. | 把除去氧化膜的镁带放入少量冷水中 | |
| C. | 把溴水滴加到KI溶液中,并加入少量四氯化碳溶液 | |
| D. | 把铜片和铁片紧靠在一起浸入稀硫酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com