
| A. | 氢氧化钙 | B. | 镁粉和氯化钾 | C. | 氯水 | D. | 氢氧化钠 |
分析 能使溴水褪色的物质应含有不饱和键或含有醛基等还原性基团的有机物以及或具有还原性或碱性的无机物,反之不能使溴水褪色,以此解答该题,
A.氢氧化钙是强碱,能和溴单质发生氧化还原反应;
B.金属镁是较活泼金属,在溴水中和溴单质发生反应;
C.氯水中各成分和溴水中各成分不发生反应;
D.氢氧化钠溶液中,氢氧化钠和溴单质发生氧化还原反应;
解答 解:A.氢氧化钙是强碱,可与溴水发生氧化还原反应,2Br2+2Ca(OH)2=CaBr2+Ca(BrO)2+2H2O,反应使溴水褪色,故A不选;
B.镁粉和氯化钾中,镁和溴单质反应生成溴化镁,Mg+Br2=MgBr2,反应可以使溴水褪色,故B不选;
C.氯水中存在化学平衡,Cl2+H2O?HCl+HClO,加入溴水不能发生反应,不能使溴水褪色,故C选;
D.氢氧化钠和溴水反应生成NaBr、NaBrO和水,Br2+2NaOH=NaBr+NaBrO+H2O,可使溴水褪色,故D不选;
故选C.
点评 本题考查物质的性质,侧重于学生的分析能力的考查,题目难度中等,注意掌握溴水的组成、化学性质,明确能够使溴水褪色的物质一般具有的化学性质是解答本题关键.


 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 正常人血液内Kw=10-14 | |
| B. | 由题给数据可算得正常人血液的pH约为7.4 | |
| C. | 正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) | |
| D. | 当过量的碱进入血液中时,只发生HCO3-+OH-=CO32-+H2O的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10ml | B. | 30ml | C. | 50ml | D. | 70ml |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
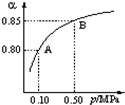 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.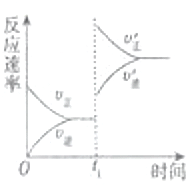
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
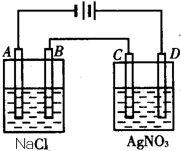 按如图进行电解实验(A、B、C、D均为惰性电极).
按如图进行电解实验(A、B、C、D均为惰性电极).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com