
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是
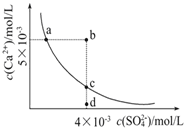
①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液;②a点对应的Ksp不等于c点对应的Ksp;③b点对应的溶液将有沉淀生成;④向d点溶液加入适量的CaCl2固体可以变到c点;⑤d点溶液通过蒸发溶剂可以变到c点;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,能使溶液由a点变为b点
A. 2句 B. 3句 C. 4句 D. 5句
【答案】A
【解析】
试题①a、c两点均可以表示CaSO4溶于水达到沉淀溶解平衡时,所形成的饱和溶液中SO42-、Ca2+浓度的关系,正确;②a、c表示在相同温度下形成CaSO4沉淀溶解平衡的点,所以a点对应的Ksp等于c点对应的Ksp,错误;③b点在沉淀溶解平衡线上,c(Ca2+)·c(SO42-)> Ksp(CaSO4)=9×10-6,所以对应的溶液将有沉淀生成,正确;④向d点溶液向d点溶液加入适量的CaCl2固体,溶液中c(Ca2+)增大,c(SO42-)减小所以不可能变到c点,错误;⑤d点溶液通过蒸发溶剂,c(Ca2+)、c(SO42-)都增大,所以不可能变到c点,错误;⑥常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积等于该温度下的溶度积常数,根据盐的组成可知c(Ca2+)=c(SO42-),所以不可能对应曲线上任意一点,错误;⑦常温下,向100mL饱和CaSO4溶液中加入400mL0.01mol/L Na2SO4溶液,CaSO4 饱和溶液c(Ca2+)=c(SO42-)=3×10-3 mol/L,加入400mL 0.01mol/L Na2SO4溶液后,c(Ca2+)=0.6×10-3 mol/L,c(SO42-)=8.6×10-3 mol/L,Qc<Ksp ,没有沉淀生成,不可能使溶液由a点变为b点,错误。可见上述叙述正确的只有2句,故选项A正确。


科目:高中化学 来源: 题型:
【题目】汽车尾气净化器中发生的反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
NO | CO | N2 | CO2 | N2 | CO2 | ||
I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
II | 400 | 0.4 | 0.4 | 0 | 0 | ||
III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确是
A. 容器I中达到平衡所需时间2s,则v(N2)=0.06 molL-1·s-1
B. 该反应的ΔS<0、ΔH<0
C. 达到平衡时,体系中c(CO)关系:c(CO,容器II)>2c(CO,容器I)
D. 若起始时向I中充入NO、CO、N2、CO2各0.1mol,开始时V正>V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示向A中充入1 mol X 、1 mol Y,向B中充入2 mol X、2 mol Y,起始时,
V(A) = V(B) = a L。在相同温度和有催化剂存在下,两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
2Z(g)+W(g) ΔH<0。达到平衡时,V(A) = 1.1a L。(连通管中气体体积不计)下列说法正确的是( )
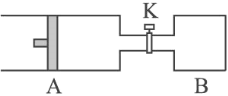
A. n(Z)B = 2n(Z)A
B. A容器中X的转化率为20%
C. 若向A和B中均再加入1molX和1molY,X的体积分数均增大
D. 打开K保持温度不变,又达到平衡时,A的体积为3.3a L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.蒸馏时可通过加碎瓷片防暴沸
B.分液漏斗在使用前要检漏
C.用加水后再分液的方法可将苯和四氯化碳分离
D.金属钠着火不可用水来灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是导致温室效应的主要气体,其对应的水溶液碳酸是可乐饮料的主要成分之一。回答下列问题:
(1)下列事实中,能证明碳酸是弱酸的是________.
A.碳酸不稳定,易分解为二氧化碳和水
B.用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍
C.相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液
D.常温下,5.0×10-6mol/L的碳酸溶液pH值为6
(2)煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol;再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol;H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol则Q1、Q2、Q3、Q4的数学关系式是___________________________________;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是_________
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
②若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
HCO3-+H+的平衡常数K1=_______。(已知:10-5.6=2.5×10-6,保留一位小数);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为中学化学中常见的单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们可以按如图进行反应。下列说法中正确的是

A. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物
B. A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱
C. 如果E溶液是一种强酸,则E溶液为硫酸
D. A、B、C中有一种金属且为B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法不正确的是( )

A. 元素b的单质不能与酸性氧化物发生化学反应
B. a、b、d、f四种元素的离子半径:f>d>a>b
C. 元素c的氧化物既能与酸反应又能与碱反应
D. a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,pH = 2的CH3COOH和H2SO4溶液各1mL,分别加水稀释到1000 mL,其溶液的pH与溶液体积(V)的关系如图所示

(1)图中a点的值为_________________
(2)若对上述硫酸再稀释10000倍则溶液中n (H+) :n(SO42-)=_______
(3)在T℃时,醋酸的电离平衡常数K=1.0×10-5, Kw=1.0×10-13则下列反应CH3COO-+H2O![]() CH3COOH+OH- 的平衡常数K=_____________。
CH3COOH+OH- 的平衡常数K=_____________。
(4)在T℃时,取pH=2的硫酸溶液0.5VmL稀释到2VmL ,与0.1mol/L的NaOH溶液0.15VmL混合后稀释至10VmL,溶液的pH=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度和有催化剂条件下,恒容密闭容器中发生反应N2+3H2 2NH3,下列说法正确的是( )
t/min | 0 | 5 | 10 | 15 | 20 |
c(NH3)/(mol·L-1) | 0 | 1.00 | 1.60 | 1.80 | 1.80 |
A. 0~10min内,v(NH3)=0.16mol·L-1·min-1 B. 0~10min内,v(N2)=0.18mol·L-1·min-1
C. 0~10min内,v(N2)=0.16mol·L-1·min-1 D. 15~20min内,反应v(N2)正= v(N2)逆=0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com