
【题目】50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中的热量可计算中和热.回答下列问题: 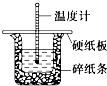
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大”、“偏小”或“无影响”).
(4)实验中改用60mL 0.50molL﹣1盐酸跟50 mL 0.55molL﹣1 NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由: .
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;用50mL 0.50molL﹣1 CH3COOH溶液(已知CH3COOH电离时吸热)进行上述实验,测得的中和热的数值会 . (均填“偏大”、“偏小”或“无影响”)
(6)平行地做一次这样的实验需要测定次温度.
【答案】
(1)环形玻璃搅拌棒
(2)隔热
(3)偏小
(4)不相等;相等;因为中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关
(5)偏小;偏小
(6)3
【解析】解:(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,所以答案是:环形玻璃搅拌棒;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是隔热,所以答案是:隔热;(3))大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,所以答案是:偏小;(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.25molL﹣1H2SO4溶液跟50mL0.55molL﹣1NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用50mL0.50molL﹣1盐酸代替H2SO4溶液进行上述实验,测得中和热数值相等,所以答案是:不相等;相等;因为中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O所放出的热量,与酸碱的用量无关;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于中和热数值;CH3COOH溶液为弱酸,电离过程为吸热过程,所以用醋酸代替稀盐酸溶液反应,反应放出的热量小于中和热数值;所以答案是:偏小;偏小;(6)实验要盐酸的温度、测量氢氧化钠溶液的温度、测量混合液的最高温度,至少需要测量3次,所以答案是:3.


科目:高中化学 来源: 题型:
【题目】下列转化不能通过一步反应完成的是
A.Al2O3→Al(OH)3B.MgCl2→Mg(OH)2C.Na2CO3→NaClD.Fe(OH)2→Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:
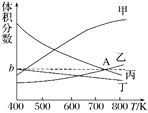
曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: . 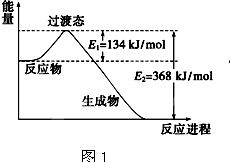
(2)观察图2a和b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系. 图a:;
图b: . 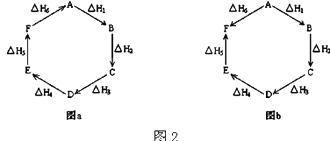
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色. 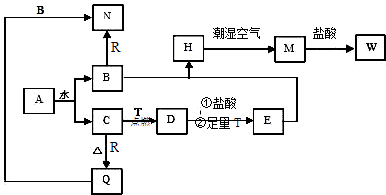
(1)写出下列物质的化学式:A , D , E , R , T .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: .
(3)按要求写方程式:B和R反应生成N的离子方程式:;M→W的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是
A. K+、Fe2+、NO3-、H+ B. Na+、Ca2+、Cl-、NO3-
C. Na+、H+、Cl-、CO32- D. Na+、Cu2+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种浅绿色盐X(仅含四种元素,不含结晶水,M(X)<908gmol﹣1)的组成和性质,设计并完成了如下实验
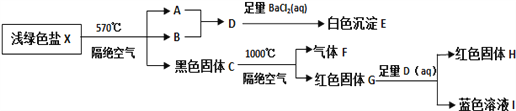
取一定量的浅绿色盐X进行上述实验,充分反应后得到23.3g白色沉淀E、28.8g红色固体G和12.8g红色固体H。
已知:①浅绿色盐X在570℃、隔绝空气条件下受热分解为非氧化还原反应.
②常温下B呈液态且1个B分子含有10个电子。请回答如下问题:
(1)写出B分子的电子式 _________
(2)请写出红色固体G与足量D溶液反应的离子方程式__________
(3)X的化学式是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日照市是山东半岛蓝色经济区的重要组成部分,对海洋资源的开发受到高度重视,下列说法正确的是
A.Mg和U都属于海水中的微量元素
B.可以利用太阳能将海水蒸馏淡化生产饮用水
C.从海水中提取溴的过程不涉及氧化还原反应
D.海底多金属结核矿含有Fe、Mn、Co、B等金属
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com