
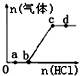
 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A. | a点对应的溶液中:Na+、Ca2+、SO42-、NO3- | |
| B. | b点对应的溶液中:K+、Na+、OH-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
分析 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性,结合对应离子的性质解答该题.
解答 解:向Na2CO3、NaHCO3,a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性,
A.a点溶液中含有CO32-和HCO3-,Ca2+与CO32-、SO42-发生反应,不能大量共存,故A错误;
B.b点全部为HCO3-,OH-与HCO3-发生互反应,在溶液中不能大量共存,故B错误;
C.c点恰好完全反应生成NaCl,溶液呈中性,Na+、Ca2+、NO3-、Cl-之间不发生任何反应,可大量共存,故C正确;
D.d点呈酸性,酸性条件下,NO3-与Fe2+发生氧化还原反应而不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考常见题型,题目难度中等,侧重于元素化合物知识的综合考查和学生的分析能力、审题的能力的考查,注意把握常见离子的性质以及反应类型的判断,明确图象中各阶段溶液的成分为解答关键.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 肼(N2H4)分子中只存在极性共价键 | |
| B. | 该反应中肼作还原剂 | |
| C. | 该反应的反应物总能量高于生成物的总能量 | |
| D. | 此情况下,液态肼燃烧生成1 mol N2时放出的热量为641.6 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用空气吹出SO2吸收法从海水中提溴时,直接将海水氯化,然后再进行吹出、吸收可得到溴产品 | |
| B. | 从海水中提取的重水可作原子能反应堆的中子减速剂和传热介质 | |
| C. | 盐田法制盐时,所用的盐田一般分成贮水池、蒸发池、结晶池三部分 | |
| D. | 利用电渗析法,冷冻法制盐,同时也可以得到淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
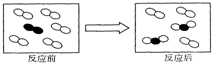
| A. | 反应前容器中的物质为单质 | |
| B. | 反应后容器中的物质为化合物 | |
| C. | 该反应为化合反应 | |
| D. | 该反应由两种反应物反应生成两种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁在干燥的环境中不易腐蚀 | |
| B. | 原电池工作时,电解质溶液中的阳离子移向正极 | |
| C. | 用铝质铆钉铆接铁板,铆接处的铁板更易被腐蚀 | |
| D. | 集中回收处理废旧电池的主要目的是防止电池中的重金属离子污染土壤和水源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3、HClO分子中所有原子都满足最外层8电子结构 | |
| B. | 某元素原子最外层电子数是次外层电子数的a(a为整数)倍,则该原子核内质子数为2a+2 | |
| C. | D2O分子与H2O分子是所含电子总数不相等的分子 | |
| D. | 在任何物质分子中都含有化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
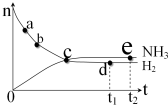 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),400℃,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示.下列叙述正确的是( )| A. | 点c处于正反应速率和逆反应速率相等 | |
| B. | 点a的正反应速率比点b的大 | |
| C. | 点d (t1时刻) 和点 e (t2时刻) 处n(N2)不同 | |
| D. | 在t2时刻,正反应速率大于逆反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com