
| A配置0.10mol/LNaOH溶液 | B.除去CO中的CO2 | C.苯萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  |  |  |
| A. | 配制0.10mol/L NaOH溶液 | |
| B. | 除去CO中的CO2 | |
| C. | 苯萃取碘水中的I2分出水层后的操作 | |
| D. | 记录滴定终点读数为12.20mL |
分析 A.容量瓶不能稀释后溶解药品,只能配制一定物质的量浓度溶液;
B.CO和NaOH不反应,二氧化碳能反应生成碳酸钠和水;
C.分液时,上层液体从上口倒出,下层液体从下口倒出;
D.滴定管大刻度在下方、小刻度在上方.
解答 解:A.容量瓶不能稀释后溶解药品,只能配制一定物质的量浓度溶液,应该将NaOH在小烧杯中溶解,冷却至室温后再将氢氧化钠溶液转移到容量瓶中,故A错误;
B.CO和NaOH不反应,二氧化碳能反应生成碳酸钠和水,所以可以用NaOH除去CO中的二氧化碳,且导气管遵循“长进短出”原则,故B正确;
C.分液时,上层液体从上口倒出,下层液体从下口倒出,苯密度小于水,所以分离苯层时从上口倒出,故C错误;
D.滴定管大刻度在下方、小刻度在上方,该刻度是11.80mL,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及实验基本操作、物质分离和提纯、仪器使用等知识点,明确实验原理、实验基本操作规范性及仪器使用方法是解本题关键,易错选项是D,注意滴定管刻度特点及其感量.


 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验桌上的酒精灯倾倒了燃烧起来,马上用水扑灭 | |
| B. | 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦 | |
| C. | 皮肤上溅有较多的浓硫酸,赶紧用水冲洗 | |
| D. | 分液时,下层液体从下端放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
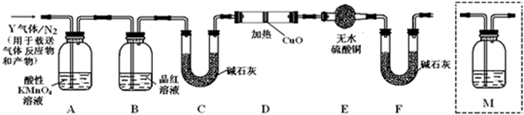
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 相关信息 |
| X | X元素可形成自然界中硬度最大的物质 |
| Y | 其单质为双原子分子,其最简单氢化物的水溶液能使酚酞变红 |
| Z | Z是短周期内最容易失去电子的元素 |
| M | M的一种同位素的质量数为34,中子数为18 |
| N | N是具有紫红色光泽的金属,有很好的延展性、导热性和导电性 |
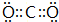 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
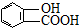 ⑤聚乙烯 ⑥
⑤聚乙烯 ⑥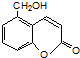

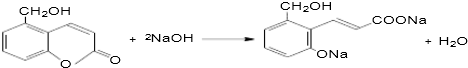
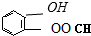 、
、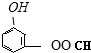 、
、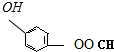
 ,聚乙二酸乙二酯H0
,聚乙二酸乙二酯H0 OCOCOOCH2CH2
OCOCOOCH2CH2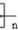 OH.
OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同质量的H2与Cl2,H2的分子数一定比Cl2多 | |
| B. | 0.5mol氢的质量是0.5g | |
| C. | 摩尔是用来衡量微观粒子多少的一种物理量 | |
| D. | 0.1mol H2SO4含有氢原子数的精确值为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
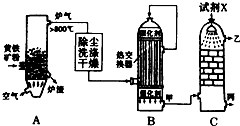 合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:
合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com