
| A. | 将少量的金属钠分别投入CuSO4溶液中,有气体放出,且溶液质量减轻 | |
| B. | 露置在空气中的金属钠表面迅速变暗,是因为钠与空气中的氧气反应生成了氧化钠 | |
| C. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔 | |
| D. | 在含有Na+、Cl-、CO${\;}_{3}^{2-}$、SO${\;}_{3}^{2-}$的溶液中加入足量Na2O2后,各离子仍能大量共存 |
分析 A.钠和水反应生成氢氧化钠和氢气,会出现气体,如果溶液质量减轻,则说明从溶液中放出气体的质量大于溶液增加的质量;
B.钠常温下与氧气反应生成氧化钠;
C.碳酸氢钠不稳定受热分解生成二氧化碳、碳酸钠和水;
D.过氧化钠具有强的氧化性,能够氧化亚硫酸根离子.
解答 解:A.钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,生成的氢氧化钠和硫酸铜反应,反应方程式为:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓,将两个方程式相加得2Na+2H2O+CuSO4=H2↑+Na2SO4+Cu(OH)2↓,根据方程式知,溶液的质量减轻,故A正确;
B.钠常温下与氧气反应生成氧化钠,表面迅速变暗,故B正确;
C.碳酸氢钠不稳定受热分解生成二氧化碳、碳酸钠和水,可以做发酵粉,故C正确;
D.过氧化钠具有强的氧化性,能够氧化亚硫酸根离子,所以加入足量Na2O2后亚硫酸根离子不存在,故D错误;
故选:D.
点评 本题考查了钠及其化合物的性质,熟悉钠与盐溶于反应是先与水反应的实质是解题关键,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6L | B. | 11.2L | C. | 2.24L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某燃料电池用熔融碳酸盐作电解质,两极分别通入CO和O2,则通入CO的一极为负极,电极反应式为CO-2e-+CO32-=2CO2 | |
| B. | Zn粒与稀硫酸反应制氢气时,为加快反应速率,可在反应过程中滴加几滴CuSO4溶液 | |
| C. | 根据自发氧化还原反应Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O设计原电池,可在常温下用铜和铁作电极,使用浓硝酸作电解质溶液 | |
| D. | 原电池中电子从负极出发,经外电路流向正极,再从正极经电解液回到负极构成闭合回路 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1;
;D若为纯净物,D的核磁共振氢谱存在2种吸收峰,面积比为1:1; ,反应类型:消去反应;
,反应类型:消去反应;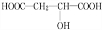 +HCOOH$?_{△}^{浓硫酸}$
+HCOOH$?_{△}^{浓硫酸}$ +H2O,反应类型:取代反应;
+H2O,反应类型:取代反应; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用前要无需检验容量瓶是否漏液 | |
| B. | 用蒸馏水洗涤后必须要将容量瓶烘干 | |
| C. | 为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 | |
| D. | 为了使所配溶液浓度均匀,定容结束后,要摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物一定是碱性氧化物 | |
| B. | 胶体和其他分散系的本质区别是分散质粒子大小不同 | |
| C. | 生石灰、醋酸、纯碱、氯化钠对应的物质类别是氧化物、酸、碱、盐 | |
| D. | 酸性氧化物一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先后滴加紫色石蕊试液、BaCl2溶液,可以将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 | |
| B. | 用加入过量CuCl2溶液,再过滤,除去Cu(NO3)2溶液中混有的AgNO3 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com