
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{10}$O | |
| B. | 氧离子(O2-)的结构示意图: | |
| C. | 某氧单质的球棍模型: | |
| D. | 某碳氧化合物电子式: |
分析 A.元素符号的左上角为质量数,质子数为8、中子数为10的氧原子的质量数为18;
B.氧离子的核电荷数为8,核外电子总数为10,最外层含有8个电子;
C.含有3个氧原子的单质为臭氧,臭氧为V型,不是直线型;
D.二氧化碳分子中含有两个碳氧双键,不存在碳氧单键.
解答 解:A.氧元素的质子数为8,具有10个中子的氧原子的质量数为18,该原子可以表示为:${\;}_{8}^{18}$O,故A错误;
B.氧离子(O2-)的核电荷数为8,最外层达到8电子稳定结构,其结构示意图为: ,故B正确;
,故B正确;
C.臭氧的空间结构为V型,不是直线型,其结构为: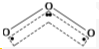 ,故C错误;
,故C错误;
D.二氧化碳分子中含有两个碳氧双键,其正确的电子式为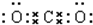 ,故D错误;
,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、球棍模型、离子结构示意图、元素符号等知识,明确常见化学用语的书写原则为解答关键,C为易错点,注意明确臭氧的空间结构.


科目:高中化学 来源: 题型:选择题
| A. | 4g D2和足量O2反应可生成D2O的分子数目为2NA | |
| B. | 0.1molCl2与足量NaOH溶液反应,转移电子的数目为0.2NA | |
| C. | 在标准状况下,2.24L氨气所含的电子总数为NA | |
| D. | 标准状况下,6.4 g氧气和臭氧中含有的分子总数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,反应MgCl2(1)═Mg(1)+Cl2(g)的△H>0△S>0 | |
| B. | 铅蓄电池放电时的负极和充电时的正极均发生氧化反应 | |
| C. | 氯化镁溶液加热蒸干得不到纯净氯化镁固体 | |
| D. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式为X(g)+3Y(g)?2Z(g)△H<0 | |
| B. | 若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率增大 | |
| C. | 达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动 | |
| D. | 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 | |
| B. | Na2O2中阴、阳离子的个数比为1:1 | |
| C. | Na2O2与CO2反应,每消耗1mol Na2O2,转移电子的物质的量为1mol | |
| D. | Na2O2的漂白原理与活性炭的漂白原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂只有锂 | |
| B. | SOCl2中每个原子都达到8电子稳定结构 | |
| C. | 氧化产物包括LiCl和SO2 | |
| D. | 生成1.12 LSO2时,反应转移电子为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com