
| A.加入催化剂,X的产率增大 |
| B.升高温度,Y的转化率增大 |
| C.当容器活塞可活动时,充入稀有气体,平衡不移动 |
| D.充入Z气体时,Z的转化率增大 |
科目:高中化学 来源:不详 题型:单选题
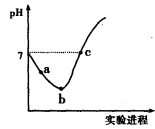
| A.实验进程中可用pH试纸测定溶液的pH |
B.c点所示溶液中: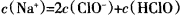 |
| C.向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强 |
D.由a点到b点的过程中,溶液中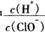 减小 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。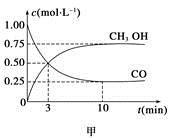
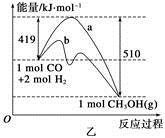
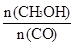 增大的有____________。
增大的有____________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应的限度都相同 |
| B.可以通过改变反应条件控制化学反应的限度 |
| C.可以通过延长化学反应的时间改变化学反应限度 |
| D.当一个化学反应在一定条件下达到限度时反应即停止 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Ni(CO)4(g)
Ni(CO)4(g)| 温度℃ | 25 | 80 | 230 |
| 平衡常数 | 5×10-4 | 2 | 1.9×10-5 |
 Ni(s)+4CO(g)的平衡常数是0.5
Ni(s)+4CO(g)的平衡常数是0.5查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )
2NH3反应,起始时N2和H2分别为10 mol 和30 mol,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是 ( )| A.40 mol 35% | B.20 mol 30% |
| C.20 mol 70% | D.10 mol 50% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 +2H2O。
+2H2O。 CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。
CH3OH(g)+H2O(g)能判断该反应已达化学反应限度标志的是 (填字母)。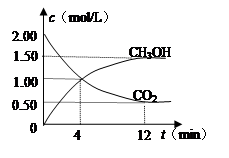
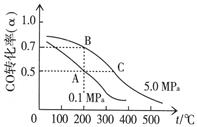
 CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。
CH3OH(g);已知密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率(α)与温度、压强的关系如右上图所示。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。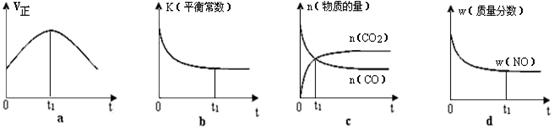
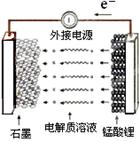 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题: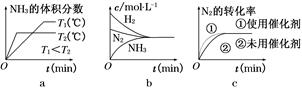
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com