


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、该反应的离子方程式为:2I-+O3+H2O═2OH-+I2+O2 |
| B、反应中每1mol臭氧参加反应电子转移数为6mol |
| C、O2是该反应的还原产物 |
| D、由该反应可知氧化性的大小顺序:O3>O2 |
查看答案和解析>>
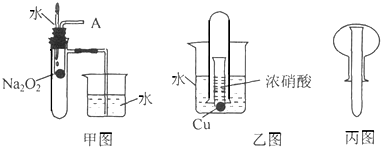
科目:高中化学 来源: 题型:
查看答案和解析>>
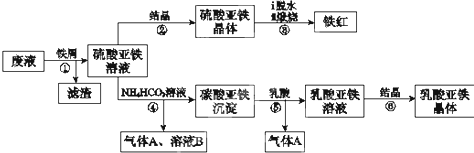
科目:高中化学 来源: 题型:
| 8 |
| 30 |
查看答案和解析>>
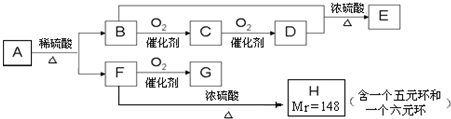
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、所用容量瓶不干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 步骤 | 操 作 | 现 象 |
| (1) | 取少许溶液向其中滴加稀盐酸 | 有气泡产生 |
| (2) | 另取少许溶液向其中滴加氯水,及CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
| A、肯定含有的离子是③④⑤ |
| B、肯定没有的离子是②⑤ |
| C、可能含有的离子是①⑥ |
| D、不能确定的离子是③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
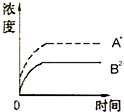
A、 |
B、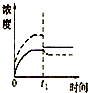 |
C、 |
D、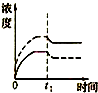 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com