
»ÆѧŌŚÄÜŌ“æŖ·¢ÓėĄūÓĆÖŠĘš×ÅŹ®·Ö¹Ų¼üµÄ×÷ÓĆ”£
(1)ŌĢ²ŲŌŚŗ£µ×µÄ”°æÉČ¼±ł”±ŹĒøßŃ¹ĻĀŠĪ³ÉµÄĶā¹ŪĻń±łµÄ¼×ĶéĖ®ŗĻĪļ¹ĢĢ唣¼×ĶéĘųĢåČ¼ÉÕŗĶĖ®Ęū»ÆµÄČČ»Æѧ·½³ĢŹ½·Ö±šĪŖ£ŗ
CH4(g)+2O2(g)====CO2(g)+2H2O(g) ¦¤H=-802.3 kJ”¤mol-1£¬
H2O(l)====H2O(g)””¦¤H=+44 kJ”¤mol-1£»
Ōņ356 g”°æÉČ¼±ł”±(·Ö×ÓŹ½ĪŖCH4”¤9H2O)ŹĶ·ÅµÄ¼×ĶéĘųĢåĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³öµÄČČĮæĪŖ”” £»
(2)0.3 molµÄĘųĢ¬øßÄÜČ¼ĮĻŅŅÅšĶé(B2H6)ŌŚŃõĘųÖŠČ¼ÉÕ£¬Éś³É¹ĢĢ¬ČżŃõ»Æ¶žÅšŗĶŅŗĢ¬Ė®£¬·Å³ö649.5 kJČČĮ棬ĘäČČ»Æѧ·½³ĢŹ½ĪŖ
”” £»
(3)¼ŅÓĆŅŗ»ÆĘųÖŠÖ÷ŅŖ³É·ÖÖ®Ņ»ŹĒ¶”Ķ锣µ±1 g¶”ĶéĶźČ«Č¼ÉÕ²¢Éś³ÉCO2ŗĶŅŗĢ¬Ė®Ź±£¬·Å³öČČĮæ50 kJ”£ŹŌŠ“³ö¶”ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½””
ӣ
(1)356 g”°æÉČ¼±ł”±(·Ö×ÓŹ½ĪŖCH4”¤9H2O)µÄĪļÖŹµÄĮæĪŖ2 mol£¬ŹĶ·ÅµÄ¼×ĶéĘųĢåĶźČ«Č¼ÉÕÉś³É4 mol H2O(g)£¬·Å³öµÄČČĮæĪŖ802.3 kJ”¤mol-1”Į2 mol =1 604.6 kJ£¬4 mol H2O(g)±ä³É4 mol H2O(l)ÓַųöČČĮæ44 kJ”¤mol-1”Į4 mol =176 kJ£¬Ōņ356 g”°æÉČ¼±ł”±ŹĶ·ÅµÄ¼×ĶéĘųĢåĶźČ«Č¼ÉÕÉś³ÉŅŗĢ¬Ė®£¬·Å³öµÄČČĮæĪŖ1 604.6 kJ+176 kJ =1 780.6 kJ”£
(2)øł¾ŻĢāŅāæÉÖŖ£¬1 molµÄĘųĢ¬øßÄÜČ¼ĮĻŅŅÅšĶé(B2H6)ŌŚŃõĘųÖŠČ¼ÉÕ£¬Éś³É¹ĢĢ¬ČżŃõ»Æ¶žÅšŗĶŅŗĢ¬Ė®£¬·Å³ö649.5 kJ”Į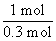 =2 165 kJČČĮ棬ĘäČČ»Æѧ·½³ĢŹ½ĪŖB2H6(g)+3O2(g)====B2O3(s)+3H2O(l) ¦¤H=-2 165 kJ”¤mol-1”£
=2 165 kJČČĮ棬ĘäČČ»Æѧ·½³ĢŹ½ĪŖB2H6(g)+3O2(g)====B2O3(s)+3H2O(l) ¦¤H=-2 165 kJ”¤mol-1”£
(3)øł¾ŻĢāŅāæÉÖŖ£¬1 mol¶”ĶéĶźČ«Č¼ÉÕ²¢Éś³ÉCO2ŗĶŅŗĢ¬Ė®Ź±£¬·Å³öČČĮæ
50”Į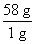 kJ=2 900 kJ£¬ĖłŅŌ¶”ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ
kJ=2 900 kJ£¬ĖłŅŌ¶”ĶéČ¼ÉÕµÄČČ»Æѧ·½³ĢŹ½ĪŖ
C4H10(g)+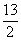 O2(g)====4CO2(g)+5H2O(l)””¦¤H=-2 900 kJ”¤mol-1”£
O2(g)====4CO2(g)+5H2O(l)””¦¤H=-2 900 kJ”¤mol-1”£
“š°ø£ŗ(1)1 780.6 kJ
(2)B2H6 (g)+3O2(g)====B2O3(s)+3H2O(l)””¦¤H=-2 165 kJ”¤mol-1
(3)C4H10(g)+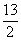 O2(g)====4CO2(g)+5H2O(l)””¦¤H=-2 900 kJ”¤mol-1
O2(g)====4CO2(g)+5H2O(l)””¦¤H=-2 900 kJ”¤mol-1


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ijŌŖĖŲµÄĶ¬Ī»ĖŲAZX£¬ĖüµÄĀČ»ÆĪļXCl2 1.11gČÜÓŚĖ®ÖĘ³ÉČÜŅŗŗó£¬ ¼ÓČė1mol/LµÄAgNO3ČÜŅŗ20mlĒ”ŗĆĶźČ«·“Ó¦.ČōÕāÖÖĶ¬Ī»ĖŲŌ×ÓŗĖÄŚÓŠ20øöÖŠ×Ó£¬Ēó£ŗ
(1)ZÖµ_________ŗĶAÖµ___________
(2)XŌŖĖŲŌŚÖÜĘŚ±ķÖŠµÄĪ»ÖĆ__________________________________£»
(3)Š“³öXµ„ÖŹÓėĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½._____________________________________________________________________
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·Ø²»ÕżČ·µÄ£Ø””””£©
| ”” | A£® | »Æѧ·“Ó¦ĖŁĀŹ“󊔵ľö¶ØŅņĖŲŹĒ·“Ó¦ĪļµÄŠŌÖŹ |
| ”” | B£® | ĖłÓŠ»Æѧ·“Ó¦£¬ĪĀ¶ČÉżøßĘä·“Ó¦ĖŁĀŹŅ»¶ØŌö“ó |
| ”” | C£® | øÖĢśøÆŹ“”¢ŹģĮĻĄĻ»Æ”¢Ź³ĪļøÆ°ÜµČ¶¼ŹĒ»Æѧ±ä»Æ£¬¼õŠ”ÕāŠ©·“Ó¦µÄĖŁĀŹÓŠĄūÓŚÉś²ś”¢Éś»ī¼°æɳ֊ų·¢Õ¹ |
| ”” | D£® | ĮņĖį¹¤Ņµ”¢ĻõĖį¹¤Ņµ”¢ĢśµÄŅ±Į¶µČ¶¼Éę¼°µ½»Æѧ·“Ó¦ĒŅ¶¼»į²śÉśĪŪČ¾£¬¼õŠ”ÕāŠ©·“Ó¦µÄĖŁĀŹÓŠĄūÓŚ½µµĶ¶Ō»·¾³µÄĪŪČ¾Ņ²ÓŠĄūÓŚ¹śĆń¾¼ĆµÄæɳ֊ų·¢Õ¹ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀ±ķŹĒŌŚĻąĶ¬ĪĀ¶ČĻĀČżÖÖĖįµÄŅ»Š©Źż¾Ż£¬ĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
| Ėį | HX | HY | HZ | ||
| ÅØ¶Č£Ømol/L£© | 0.12 | 0.2 | 0.9 | 1 | 1 |
| µēĄė¶Č | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| µēĄė³£Źż | K1 | K2 | K3 | K4 | K5 |
A£®ŌŚĻąĶ¬ĪĀ¶Č£¬“ÓHXµÄŹż¾ŻæÉŅŌĖµĆ÷£ŗČõµē½āÖŹČÜŅŗ£¬ÅضČŌ½µĶ£¬µēĄė¶ČŌ½“ó£¬ĒŅK1£¾K2£¾K3=0.01
B£®ŹŅĪĀŹ±£¬ČōŌŚNaZČÜŅŗÖŠ¼ÓĖ®£¬Ōņc(£ØZ£)/ [c(HZ)• c(OH£)]µÄ±ČÖµ±äŠ”£¬Čō¼ÓÉŁĮæŃĪĖį£¬Ōņ±ČÖµ±ä“ó
C£®µČĪļÖŹµÄĮæµÄNaX”¢NaYŗĶNaZµÄ»ģŗĻŅŗ£¬c(X£)+c(Y£)£2c(Z£)=2c(HZ)£c(HX)£c(HY)£¬ĒŅc(Z£)<c(Y£)<c(X£)
D£®ŌŚĻąĶ¬ĪĀ¶ČĻĀ£¬K5£¾K4£¾K3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
A.ŌŚ»Æѧ·“Ó¦ÖŠ·¢ÉśĪļÖŹ±ä»ÆµÄĶ¬Ź±£¬²»Ņ»¶Ø·¢ÉśÄÜĮæ±ä»Æ
B.¦¤H>0±ķŹ¾·ÅČČ·“Ó¦£¬¦¤H<0±ķŹ¾ĪüČČ·“Ó¦
C.¦¤HµÄ“óŠ”ÓėČČ»Æѧ·“Ó¦·½³ĢŹ½ÖŠ»Æѧ¼ĘĮæŹżĪŽ¹Ų
D.Éś³ÉĪļŹĶ·ÅµÄ×ÜÄÜĮæ“óÓŚ·“Ó¦ĪļĪüŹÕµÄ×ÜÄÜĮæŹ±£¬¦¤H<0
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ČČ»¹Ō·ØŅ±Į¶½šŹōµÄ·“Ó¦Ņ»¶ØŹĒ””(””””)
A.Ńõ»Æ»¹Ō·“Ó¦ B.ÖĆ»»·“Ó¦
C.ø“·Ö½ā·“Ó¦ D.·Ö½ā·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
·“Ó¦2SO2(g)+O2(g) 2SO3(g)¾¹żŅ»¶ĪŹ±¼äŗó£¬SO3µÄÅضČŌö¼ÓĮĖ
2SO3(g)¾¹żŅ»¶ĪŹ±¼äŗó£¬SO3µÄÅضČŌö¼ÓĮĖ
0.4 mol”¤L-1£¬²āµĆŌŚÕā¶ĪŹ±¼äÄŚÓĆSO2µÄÅØ¶Č±ä»Æ±ķŹ¾µÄ·“Ó¦ĖŁĀŹĪŖ
0.04 mol”¤L-1”¤s-1£¬Ōņ”°Õā¶ĪŹ±¼ä”±ĪŖ(””””)
A.10 s”””” ”” B.5 s”” ””””C.2.5 s”””””” D.0.1 s
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
1mol•L﹣1ĮņĖįČÜŅŗµÄŗ¬ŅåŹĒ£Ø””””£©
| ”” | A£® | 1LĖ®ÖŠŗ¬ÓŠ1molĮņĖį |
| ”” | B£® | 1LČÜŅŗÖŠŗ¬1mol H+ |
| ”” | C£® | ½«98gĮņĖįČÜÓŚ1LĖ®ĖłÅä³ÉµÄČÜŅŗ |
| ”” | D£® | Öø1LĮņĖįČÜŅŗÖŠŗ¬ÓŠ98g H2SO4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
ѻʬ¾ßÓŠø“ŌÓµÄ×é³É£¬ĘäÖŠµÄóæĖŚ¼īµÄ·Ö×Ó½į¹¹ČēĻĀ£ŗѻʬ×īŌēÓĆÓŚŅ©Īļ£ØÓŠÖ¹Ķ“”¢Ö¹Šŗ”¢Ö¹æČ×÷ÓĆ£©£¬³¤ĘŚ·žÓĆ»į³Éń«£¬Ź¹ČĖĢåÖŹĖ„Čõ£¬¾«ÉńĶĒ·Ļ£¬ŹŁĆüĖõ¶Ģ£®ŅŃÖŖøĆĪļÖŹµÄČ¼ÉÕ²śĪļĪŖCO2”¢H2OŗĶN2£¬1moløĆ»ÆŗĻĪļĶźČ«Č¼ÉÕĻūŗÄO2µÄĪļÖŹµÄĮæ¼°ŌŚŅ»¶ØĢõ¼žĻĀÓėBr2·¢Éś±½»·Č”“ś·“Ӧɜ³ÉµÄŅ»äå“śĪļĶ¬·ÖŅģ¹¹ĢåµÄÖÖŹż·Ö±šŹĒ£Ø””””£©
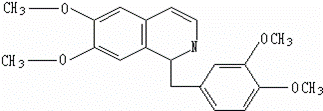
| ”” | A£® | 23.25 mol£»5 | B£® | 24.5 mol£»7 | C£® | 24.5 mol£»8 | D£® | 26.5 mol£»6 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com