
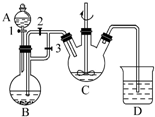
 某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:
某化学兴趣小组用FeCl2(用铁粉与盐酸反应制得)和NH4HCO3制备FeCO3的装置示意图如图所示.回答下列问题:分析 亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,据此进行解答.
解答 解:亚铁离子容易被氧气氧化,制备过程中应在无氧环境中进行,Fe与盐酸反应制备氯化亚铁,利用反应生成的氢气排尽装置中的空气,故B制备氯化亚铁,C装置中FeCl2和NH4HCO3发生反应:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,
(1)根据仪器的构造可知仪器C为三颈烧瓶;C装置中FeCl2和NH4HCO3发生反应为:FeCl2+2NH4HCO3=FeCO3↓+2NH4Cl+CO2↑+H2O,改写成离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,
故答案为:三颈烧瓶;C;Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;
(2)亚铁离子易被空气中氧气氧化,实验时首先打开活塞3,关闭活塞2,排出装置中的空气,防止+2价铁被氧化;
然后再关闭活塞3,打开活塞2,利用生成氢气,使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中,
故答案为:排出装置中的空气,防止+2价铁被氧化;使B装置中气压增大,将B装置中的氯化亚铁溶液压入C中.
点评 本题考查制备方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、离子方程式书写、氧化还原反应滴定应用等,明确实验原理为解题关键,是对学生综合能力的考查.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 mol | B. | 11 mol | C. | 12 mol | D. | 13 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q与Y组成的常见物质是一种两性物质,结构中含有共价键 | |
| B. | 已知WRZQ3溶液呈酸性,若将WRZQ3固体溶于水,能促进水的电离 | |
| C. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子 | |
| D. | 元素T、Q、W、Y的原子半径大小为T<Q<Y<W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1 L 0.1 mol•L-1 的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,2.24 L己烷中共价键数目为1.9NA | |
| C. | 室温下,28.0 g乙烯和丁烯的混合气体中含有的碳原子数为2NA | |
| D. | 足量Fe与标准状况下22.4 L Cl2充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
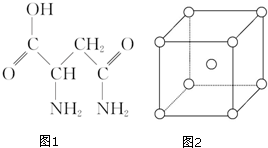 芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图1)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 化学式 | 键长/nm | 键角 |
| H2O | 0.99 | 104.5° |
| H2S | 1.34 | 92.3° |
| H2Se | 1.47 | 91.0° |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +45 kJ/mol | B. | +32.7 kJ/mol | C. | -45 kJ/mol | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com