
【题目】下列仪器使用前必须检查是否漏水的有(填序号)
科目:高中化学 来源: 题型:
【题目】室温下,将100 mL的NaOH和Ba(OH)2混合碱溶液分成两等份,一份加入过量的Na2SO4溶液,充分反应后得到沉淀2.33 g;另一份加入50 mL0.1 mol/LH2SO4溶液,充分反应后溶液中c(OH-)为0.3 mol/L(此时溶液的体积为100 mL),试计算:
(1)原混合碱溶液中所含Ba(OH)2的物质的量是________。
(2)原混合溶液中NaOH的物质的量浓度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.活化分子间的碰撞一定发生化学反应
B.吸热反应只有加热才能发生
C.有能量变化的一定是化学反应
D.有化学键断裂不一定发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
2NH3(g)(△H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)在3个阶段中,N2的平均反应速率![]() (N2)、
(N2)、![]() (N2)、
(N2)、![]() (N2)中最大的是 ,其值是 。
(N2)中最大的是 ,其值是 。
(2)H2的平衡转化率αⅠ(H2)、αⅡ(H2)、αⅢ(H2)的大小关系是 。
(3)由第一次平衡到第二次平衡,平衡移动的方向是 (填“正反应方向”或“逆反应方向”),采取的措施是 。
(4)第Ⅰ阶段时,化学平衡常数K1= ;第Ⅱ、Ⅲ阶段化学平衡常数K2 K3;(填“>、<、=”)判断的理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化需克服相同类型作用力的是( )
A. 碘和干冰的升华
B. Na2O2和C60的熔化
C. 氯化氢和氯化钾的溶解
D. 溴的汽化和NH4Cl加热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,反应速率增大,平衡向逆反应方向移动
③压缩容器增大压强,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.② C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。已知:① 装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2===Na2S2O5;
② Na2S2O5晶体在空气中被氧化生成Na2SO4。
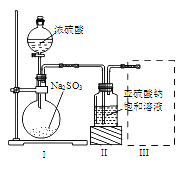
(1) 装置Ⅰ中产生气体的化学方程式为:_____________________________。
(2) 要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是 。
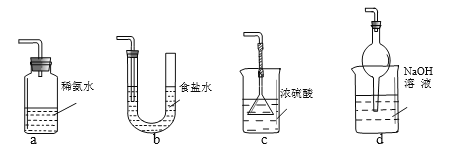
(3) 装置Ⅲ用于处理尾气,可选用右图中最合理装置(夹持仪器已略去)为___________(填序号)。
(4)检测Na2S2O5晶体在空气中已被氧化的实验方案是: 。
(5)为了研究Cl2与SO2的在干燥条件下发生反应及进行的程度。用右下图所示装置收集满干燥的Cl2,再通入干燥的SO2,集气瓶中立即出现无色液体SO2Cl2; 充分反应后,将液体和剩余气体分离。用除尽空气的NaOH溶液吸收分离出的气体,用足量稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀,该白色沉淀是 ,由此可知反应后剩余的气体为Cl2和 ,综合实验信息,干燥的SO2与Cl2反应的化学方程式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是
A. Na+、Ba2+、Cl-、SO42-
B. Ca2+、HCO3-、C1-、K+
C. MnO4-、K+、I-、H+
D. H+、Cl-、Na+、CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com