
| A. | SO2使品红溶液褪色 | B. | 氯水使紫色石蕊试液褪色 | ||
| C. | SO2使高锰酸钾溶液褪色 | D. | 活性炭使比墨水褪色 |
科目:高中化学 来源: 题型:选择题
| A. | 只有Fe2+和Cu2+ | B. | 一定有Fe2+、Cu2+,可能有Fe3+ | ||
| C. | 一定有Fe2+,可能有Cu2+ | D. | 只有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向100ml浓度均为1mol/LFeI2、FeBr2混合溶液中通入标况下4.48L的氯气:3Cl2+2Fe2++4I-=2I2+2Fe3++6Cl- | |
| B. | 将1 mol•L-1 NaAlO2溶液和1.5 mol•L-1的HC1溶液等体积混合:6AlO2-+9H++3H2O═5Al(OH)3↓+Al3+ | |
| C. | 在澄清石灰水中加入过量的Ca(HCO3)2溶液:2OH-+Ca2++2HCO3-═CaCO3↓+CO32-+2H2O | |
| D. | 向NaClO溶液加入少量FeCl2溶液:2Fe2++ClO-+2H+═2Fe3++2H2O+Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

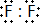 ,两者气态氢化物的稳定性是:HF>HCl(填写化学式).
,两者气态氢化物的稳定性是:HF>HCl(填写化学式).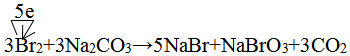 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 0.1mol•L-1FeCl3溶液中,K+、Na+、I-、SCN- | |
| B. | 在$\frac{{c({H^+})}}{{c(O{H^-})}}={10^{12}}$的溶液中Al3+、NO3-、K+、Cl- | |
| C. | 1.0mol•L-1KMnO4溶液,H+、Fe2+、Cl-、SO42- | |
| D. | 通入大量 CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
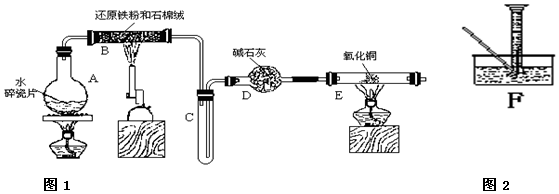
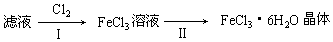
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com