


分析 (1)有机物中的原子或原子团被其它的原子或原子团所代替的反应为取代反应;有机物的燃烧、碳碳不饱和键被氧化的反应都属于氧化反应;
(2)在浓硫酸作催化剂、加热条件下,甲苯和浓硝酸发生取代反应生成三硝基甲苯;
在加热条件下,溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯.
解答 解:(1)有机物中的原子或原子团被其它的原子或原子团所代替的反应为取代反应;有机物的燃烧、碳碳不饱和键被氧化的反应都属于氧化反应,属于取代反应的有③⑦,属于氧化反应的有①④,
故答案为:③⑦;①④;
(2)在浓硫酸作催化剂、加热条件下,甲苯和浓硝酸发生取代反应生成三硝基甲苯,反应方程式为 ;
;
在加热条件下,溴乙烷和氢氧化钠的醇溶液发生消去反应生成乙烯,反应方程式为CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O,
故答案为: ;CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O.
;CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O.
点评 本题考查有机物反应、化学方程式的书写等知识点,明确官能团及其性质关系是解本题关键,知道常见反应类型特点,注意:水解反应、酯化反应、硝化反应、磺化反应都属于取代反应.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
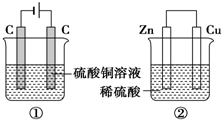 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤素单质的密度逐渐增大 | |
| B. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| C. | 将氯水加到KI淀粉溶液中,溶液变蓝 | |
| D. | 它们的原子核外电子层数随核电荷数的增加而增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
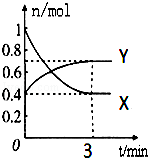 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4(g)(无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 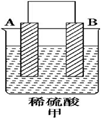 |  | 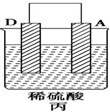 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
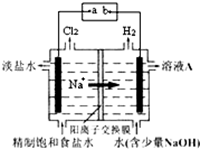 氯碱工业中电解饱和食盐水的原理示意图如图所示.
氯碱工业中电解饱和食盐水的原理示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
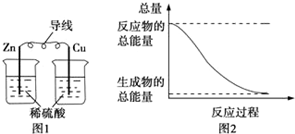
| A. | 图1所示的装置能将化学能转变为电能 | |
| B. | 图2所示的反应为吸热反应 | |
| C. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| D. | 中和反应中,反应物的总能量比生成物的总能量低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com