
分析 (1)①根据CuCO3受热分解得到CuO和CO2、Cu(OH)2受热分解得到CuO和H2O,然后氢气与CuO反应生成水,所以xCuCO3•yCu(OH)2•zH2O与氢气反应的产物有:Cu、CO2、H2O,最后根据将碱式碳酸铜前面系数定为1,根据反应前后各原子种类和个数不变配平.
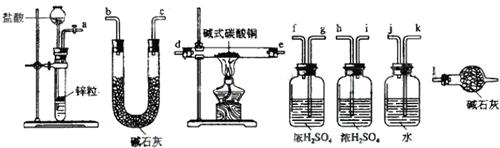
②本实验的原理,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;
③根据化学方程式生成物之间的质量关系求出x、y、z,根据生成的水和反应物中水的关系求解水的质量.
(2)根据反应xCuCO3•yCu(OH)2•zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成.
解答 解:(1)①xCuCO3•yCu(OH)2•zH2O与氢气反应的产物有:Cu、CO2、H2O,方程式为:xCuCO3•yCu(OH)2•zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O,
故答案为:xCuCO3•yCu(OH)2•zH2O+(x+y)H2=(x+y)Cu+xCO2+(x+2y+z)H2O;
②本实验的原理,用干燥的氢气与碱式碳酸铜反应,通过测定生成的二氧化碳和水以及反应后固体的质量来确定物质的组成,为防止空气中CO2和H2O进入U型干燥装置,可在最后再连接一个盛有碱石灰的干燥装置来吸收空气中的二氧化碳和水;氢气流方向的连接顺序是a→k,j→gf(hi)→de(ed)→hi(gf)→bc(cb)→l,
故答案为:kj→gf(hi)→de(ed)→hi(gf)→bc(cb);
③xCuCO3•yCu(OH)2•zH2O+( x+y)H2=(x+y)Cu+xCO2↑+(x+2y+z)H2O
64(x+y) 44x 18(x+2y+z)
12.7g 4.4g 7.2g
$\frac{64(x+y)}{12.7}$=$\frac{44}{4.4}$
解得:y=x
$\frac{44}{4.4}$=$\frac{18(x+2y+z)}{7.2}$,
解得:z=x
令x=1,则y=1,z=1,则化学式为CuCO3•Cu(OH)2•H2O,化学方程式为CuCO3•Cu(OH)2•H2O+2H2=2Cu+CO2↑+4H2O,由化学方程式可以看出,碱式碳酸铜每1个水分子能生成4个水分子,即生成的水中碱式碳酸铜中水占了$\frac{1}{4}$,因此碱式碳酸铜中水的质量为:7.2g×$\frac{1}{4}$=1.8g,
故答案为:1.8g;CuCO3•Cu(OH)2•H2O;
(2)根据反应xCuCO3•yCu(OH)2•zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成,
故答案为:可行;根据反应xCuCO3•yCu(OH)2•zH2O=(x+y)CuO+xCO2↑+(y+z)H2O↑,依据碱式碳酸铜、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成.
点评 本题难度较大,关键是配平化学方程式,要分析出实验原理及其计算,能根据化学方程式进行计算.


科目:高中化学 来源: 题型:多选题
| A. | 用于青奥村工程隔热保温材料聚氨酯属于有机高分子材料 | |
| B. | 青奥会议中心双塔采用了玻璃幕墙设计,制造玻璃的主要原料为纯碱和石灰石 | |
| C. | 青奥中心外墙的复合保温材料采用铝合金锁边,铝合金比金属铝更具有强度大、耐腐蚀的优点 | |
| D. | 青奥会健身中心的地面采用了聚苯乙烯保温板,聚苯乙烯的结构简式为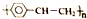 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 豆浆 | B. | NaCl溶液 | C. | HCl | D. | 空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
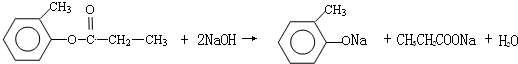
.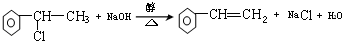 ,E+C→F
,E+C→F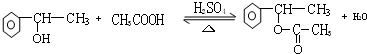
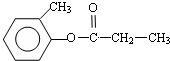
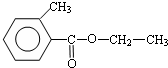
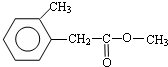
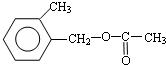

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

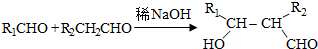
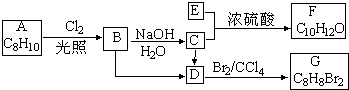
 .
. .
. ;
; (写结构简式)
(写结构简式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烃的分子式为 C10H14,它不能使溴水因反应而褪色,但可使酸性 KMnO4 溶液褪色,且分子结构中只有一个烷基,符合条件的芳香烃有 4 种(已知: KMnO44氧化) KMnO44氧化) | |
| B. | 2,4-二甲基-3,3-二乙基戊烷的一氯代物有4种 | |
| C. | 甲烷与氯气的混合气体在光照条件下反应生成的有机化合物均无同分异构体 | |
| D. | 乙烷与丙烯的物质的量共 1mol,完全燃烧生成 3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,试写出对应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1.标准状况下11.2L氢气在氯气中充分燃烧放出的热量是92.3kJ.
(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6kJ的热量,试写出对应的热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-184.6 kJ•mol-1.标准状况下11.2L氢气在氯气中充分燃烧放出的热量是92.3kJ.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类、选项 | 酸 | 碱 | 盐 | 碱性氧化物 |
| A | H2SO4 | Na2CO3 | NaHCO3 | CaO |
| B | HCl | NH3•H2O | NaCl | Na2O |
| C | CO2 | Cu(OH)2 | MgCl2 | Na2O |
| D | HNO3 | KOH | CaO | CO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com