
| A. | Al3+、CH3COO-、Cl- | B. | Mg2+、Ba2+、Br- | ||
| C. | Mg2+、Cl-、I- | D. | Na+、NH4+、Cu2+ |
科目:高中化学 来源: 题型:解答题
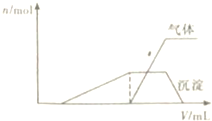 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
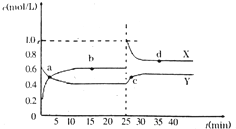
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Cl-)=c(CH3COO-)的盐酸和醋酸溶液 | |
| B. | 水的电离程度相同的稀硫酸和盐酸 | |
| C. | 水的电离程度相同的氯化按溶液和硫酸铜溶液 | |
| D. | 铵根离子浓度相同的硫酸铵和硫酸氢铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同状况下,同体积的乙醇气体和乙烯气体究全燃烧,耗氧量不相同 | |
| B. | 在相同状况下,同体积的乙醇气体和乙烯气体完全燃烧,放出的热量相同 | |
| C. | 用乙醇作燃料不会导致“温窒效应” | |
| D. | 用乙醇作燃料不会导致酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素.已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
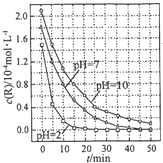
| A. | 在0-50min之间,pH=2 和 pH=7 时 R 的降解百分率相等 | |
| B. | 溶液酸性越强,R 的降解速率越小 | |
| C. | R的起始浓度越小,降解速率越大 | |
| D. | 在 20-25min之间,pH=10 时 R 的平均降解速率为 0.04mol•L-1•min-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com