
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
【答案】 a/2+10-b-10b-14 1072.7 0.01mol·L-1·min-1 10000 C < 180℃ 不
【解析】(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,根据电荷守恒,c(CH3COO-)+ c(OH-)= c(Li+)+ c(H+),因此c(CH3COO-)+10b-14 mol/L =![]() mol/L +10-b mol/L,整理得:c(CH3COO-) =
mol/L +10-b mol/L,整理得:c(CH3COO-) =![]() mol/L +10-b mol/L-10b-14 mol/L=(
mol/L +10-b mol/L-10b-14 mol/L=(![]() +10-b-10b-14)mol/L,故答案为:
+10-b-10b-14)mol/L,故答案为: ![]() +10-b-10b-14;
+10-b-10b-14;
(2)根据反应Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol可知,ΔH=反应物的键能之和-生成物的键能之和,则C≡O的键能为=(-41.3 kJ/mol)-(2×464kJ/mol)+(2×803kJ/mol+436kJ/mol)=1072.7 kJ/mol,故答案为:1072.7;
(3)① 2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),
CH3COOCH=CH2(g)+2CH3COOH(g),
起始(mol) 0.2 0.4 0.1 0 0
反应(mol) 2x 4x x x 2x
平衡(mol) 0.2-2x 0.4-4x 0.1-x x 2x
则![]() ×100%=10%,解得:x=0.05mol,0~10min内,用CO浓度变化表示的平均反应速率v(CO)=
×100%=10%,解得:x=0.05mol,0~10min内,用CO浓度变化表示的平均反应速率v(CO)= 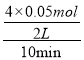 = 0.01mol·L-1·min-1;该温度下,该反应的平衡常数K=
= 0.01mol·L-1·min-1;该温度下,该反应的平衡常数K=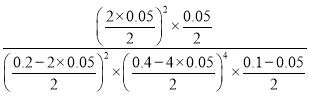 =10000,故答案为:0.01mol·L-1·min-1;10000;
=10000,故答案为:0.01mol·L-1·min-1;10000;
②A.V正(DME)=v逆(H2),表示的正逆反应速率不等,不是平衡状态,故A错误;B.该反应中气体的质量和体积始终不变,混合气体的密度始终不变,不表示是平衡状态,故B错误;C. ![]() =
=![]() ,该反应恰好气体的物质的量发生变化,因此混合气体的平均相对分子质量不再变化,说明是平衡状态,故C正确;D. c(CO):c(VAC)与起始浓度和反应的方程式有关,与平衡状态无关,故D错误;故选C;
,该反应恰好气体的物质的量发生变化,因此混合气体的平均相对分子质量不再变化,说明是平衡状态,故C正确;D. c(CO):c(VAC)与起始浓度和反应的方程式有关,与平衡状态无关,故D错误;故选C;
③根据图像,升高温度,二甲醚(DME)的转化率减小,说明平衡逆向移动,则反应的ΔH<0,180℃时,醋酸乙烯(VAC)选择性最高,最佳的反应温度为180℃,故答案为:<;180℃;
④保持温度不变,向反应釜中通入氩气增大压强,但物质的浓度不变,平衡不移动,故答案为:不。


科目:高中化学 来源: 题型:
【题目】某学习小组在实验室中利用下图装置(夹持装置略去)测定某铁硫化物(FexSy)的组成,并探究反应后D装置所得溶液中含硫化合物的组成。

实验步骤:
步骤I如图连接装置,检查装置气密性,装入药品;
步骤II旋开滴液漏斗活塞与旋塞,并点燃酒精喷灯;
步骤III当硬质玻璃管中固体质量不再改变时,停止加热,继续向烧瓶中滴水一段时间
步骤IV实验结束后,将D中所得溶液加水配制成250mL溶液;
……
请回答:
(1)步骤III中,停止加热后还需继续向烧瓶中滴水一段时间,其目的为___________________。
(2)在C、D装置之间不需要防倒吸装置的理由是_______________________________________。
(3)步骤IV中配制溶液时所需的玻璃仪器除玻璃棒和烧杯外,还有_____________________。
(4)取25.00mL步骤IV 中所配溶液,加入足量的双氧水,再加入足量盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为4.66g。则FexSy的化学式为________________。
(5)有同学认为可将装置D改为装有足量碱石灰的干燥管,通过测定反应前后干燥管的增重来计算硫元素的含量。你认为此方案____(填“是”或“否”)合理,原因为_____________________。
(6)反应后D装置所得溶液中除含有Na2SO4外,还可能含有Na2SO3。现用滴定法测定溶液中Na2SO3的含量。可供选择的试剂:①0.1000mol/LKMnO4酸性溶液;②0.1000mol/LH2O2溶液;③0.1000mol/LKI淀粉溶液;④0.1000 mol/LBaCl2溶液;⑤0.1000mol/LHCl溶液。
①所选试剂应装在_____(填“酸式”或“碱式”) 滴定管中。
②所利用的反应原理为___________________________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素④、⑨形成的氢化物的稳定性顺序为_____>______(填化学式)。
(3)表中元素③、④、⑥、⑦的原子半径大小为____>____>___>___(填元素符号)。
Ⅱ.A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。(2) E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化硼是平面正三角形,因此是非极性分子,推断三氯甲烷(碳原子位于分子结构中心)的结构和分子的极性情况是( )
A. 四面体,极性分子 B. 平面三角形,非极性分子
C. 正四面体,非极性分子 D. 平面三角形,极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质(括号内为杂质)的分离提纯方法错误的是( )
A. 溴苯(溴):氢氧化钠,分液 B. 乙酸乙酯(乙酸):氢氧化钠,分液
C. 乙醇(水):新制生石灰,蒸馏 D. 甲烷(乙烯):溴水,洗气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业。某化学兴趣小组在实验室中利用下列装置模拟工业制备纳米CaCO3.
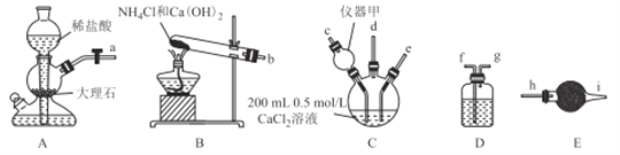
请回答下列问题:
(1)仪器甲的名称是________,在该实验中,其作用是_____.
(2)将上述接口连接顺序补充完整:a![]() ;b
;b![]() ;d
;d![]() 。__________
。__________
(3)装置D中选择的试剂是__________(填序号,下同),装置E中选择的试剂是__________
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为__________
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为_______(结合化学用语解释)。
(6)当生成5g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为_________
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0mol/L的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中c(SO32-)/c(CO32-)的值(x)的取值范围为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
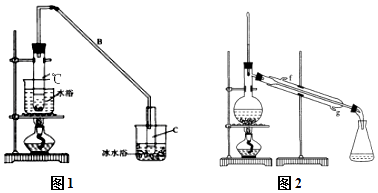
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 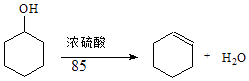
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 , 导管B除了导气外还具有的作用是 .
②试管C置于冰水浴中的目的是 .
(2)制备精品: ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后,用(填编号)洗涤环己烯.
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液 D.NaOH溶液
②再将环己烯按图2装置蒸馏,冷却水从(填f或g)口进入,蒸馏时要加入生石灰,目的是 .
③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 .
A.蒸馏时从70℃开始收集产品 B.环己醇实际用量多了 C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,最简单的方法是 .
A.酸性KMnO4溶液
B.用金属钠
C.测定沸点
D.溴的四氯化碳溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F基态原子的核外电子排布式为______________________。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是___________(用元素符号回答)。
(3)元素B的简单气态氢化物的沸点___________(填“高于”或“低于”)元素A的简单气态氢化物的沸点,其主要原因是______________________。
(4)由A、B、C形成的离子CAB与AC2互为等电子体,则CAB的结构式为___________。
(5)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为___________。

(6)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL﹣1的醋酸溶液中逐滴加入0.1000molL﹣1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( ) 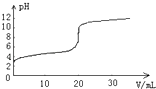
A.在反应过程中始终,c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣)
B.pH=4时,c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
C.pH=6时,c(CH3COO﹣)+c(CH3COOH)=0.1000 molL﹣1
D.pH=7时,消耗NaOH溶液的体积小于20.00mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com