
| A. | 煤燃烧时,化学能主要转化为热能 | |
| B. | 白炽灯工作时,电能转化为光能 | |
| C. | 电解水生成氢气和氧气时,化学能转化为电能 | |
| D. | 绿色植物进行光合作用时,太阳能转化为化学能 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
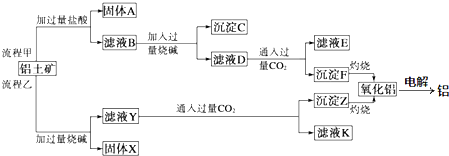
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
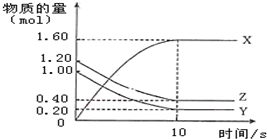 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间里每增加1molN2,同时减少2molNH3 | |
| B. | c(N2):c(H2):c(NH3)=1:1:1 | |
| C. | N2与H2的物质的量与NH3的物质的量相等 | |
| D. | N2、H2和NH3的质量分数不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
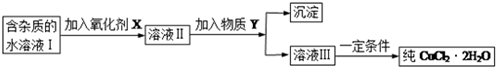
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com