
【题目】在2L密闭容器,800℃时发生如下反应:
2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)写出该反应的平衡常数表达式 。
已知:K(400℃)>K(350℃),则该反应是 热反应。
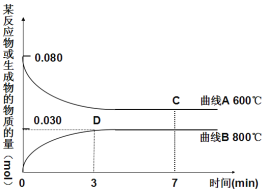
(2)右图中表示Cu2O的物质的量随时间变化的曲线是 (选填“A”或“B”),800℃时,0~3min内该反应的平均速率v (CO2)= 。
(3) 能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2) b.容器内压强保持不变
c.v逆(CO)=v正(CO2) d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
A.增加CuO的量
B.适当升高温度
C.及时移去CO2
D.增大CO的浓度
E.选择高效催化剂
F.增大压强
【答案】(1)![]() ;吸;(2)B;0.005mol/(L·min);(3)c d;(4)BD;
;吸;(2)B;0.005mol/(L·min);(3)c d;(4)BD;
【解析】
试题分析:(1)已知2CuO(S)+CO(g) ![]() Cu2O(s)+CO2(g),则K=
Cu2O(s)+CO2(g),则K=![]() ;已知:K(400℃)>K(350℃),即升高温度K增大,平衡正移,所以正方向为吸热方向,故答案为:K=
;已知:K(400℃)>K(350℃),即升高温度K增大,平衡正移,所以正方向为吸热方向,故答案为:K=![]() ;吸;
;吸;
(2)Cu2O是生成物,物质的量增大,因此表示Cu2O的物质的量随时间变化的曲线是B;由图可知n(Cu2O)=0.03mol,根据方程式可知,n(CO)=n(Cu2O)=0.03mol,所以c(CO)=![]() =
=![]() =0.015mol/L,所以v(CO)=
=0.015mol/L,所以v(CO)=![]() =
=![]() =0.005mol/(Ls),故答案为:B;0.005mol/(Ls);
=0.005mol/(Ls),故答案为:B;0.005mol/(Ls);
(3)a.v(CO)=v(CO2),没有说明正速率和逆速率的关系,故错误;b.反应前后气体的物质的量不变,所以压强始终不变,所以不能用容器内压强判断平衡,故错误;c.v逆(CO)=v正(CO2),由于二者的计量数相等,所以v正(CO)=v正(CO2),因此v逆(CO)=v正(CO),所以是平衡状态,故正确;d.反应前后气体的体积不变,气体质量增大,所以密度增大,因此密度不变就是平衡状态,故正确;故答案为:cd;
(4)A.CuO是固体,增加CuO的量,速率不变,平衡不移动;B.适当升高温度,速率增大,平衡正移;C.及时移去CO2,速率减小,平衡正移;D.增大CO的浓度,速率增大,平衡正移;E.选择高效催化剂,速率增大,平衡不移动;F.增大压强,速率增大,平衡不移动;所以能使该反应的正反应速率增大,且平衡向正反应方向移动的是BD;故答案为:BD。


科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
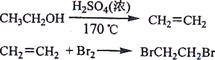
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l 40℃脱水生成乙醚。
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | 一l30 | 9 | -1l6 |
回答下列问题:
(1)在此制各实验中,要尽可能迅速地把反应温度提高170℃左右,其最主要目的是 ;(填正确选项前的字母)
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入 ,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是 ;
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在 层(填“上”、“下”);
(5)若产物中有少量未反应的Br2,最好用 洗涤除去;(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚.可用 的方法除去;
(7)反应过程中应用冷水冷却装置D,其主要目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据研究,若把太阳光变成激光用于分解海水制氢,反应可表示为:![]() 。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
。有下列几种说法:① 水分解反应是放热反应;② 氢气是可再生能源;③ 使用氢气作燃料有助于控制温室效应;④ 若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件。其中叙述正确的是( )
A.①② B.③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应3A(g)+B(g) ===2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(L·min)、②vC=0.5 mol/(L·min)、③vB=0.5 mol/(L·min),三种情况下该反应速率由大到小的关系是 。(用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
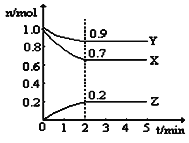
①该反应的化学方程式为____________________________。
②反应开始至2min,以气体Z表示的平均反应速率为 。
③2min反应达平衡容器内混合气体的平均相对分子质量比起 始时 (填“大”,“小”或“相等”下同),混合气体密度比起始时 。
④上述反应,在第2min时,X的转化率为 。
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) = n (Y) = n (Z),则原混合气体中a : b =__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A. 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B. 0.5molO3与11.2LO2所含的分子数一定相等
C. 物质的量浓度为0.5mol/L MgCl2溶液,含有Cl-数为NA
D. 1molFe与足量稀盐酸反应时,转移电子的数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PM2.5指大气中直径小于或等于2.5微米(1微米等于10-6m ) 的颗粒物,对空气质量和能见度有重要影响。若将直径为2.5微米颗粒物分散到水中,形成的分散系属于( )
A. 溶液 B. 胶体 C. 浊液 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的叙述不正确的是
A.淀粉水解可以制得葡萄糖
B.碘酒可使细菌、病毒的蛋白质变性而死亡
C.氨基酸是两性化合物,能与酸或碱反应生成盐
D. 光导纤维遇盐酸和氢氧化钠溶液都不会被损坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等能相互转化.则化学能与其他能量相互转化说法正确的是( )
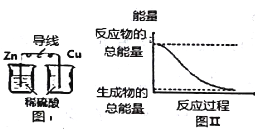
A. 中和反应中,反应物的总能量比生成物的总能量低
B. 化学反应中能量变化的主要原因是化学键的断裂与生成
C. 图I所示的装置能将化学能转变为电能
D. 图Ⅱ所示的反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com